高中 | 导电的原因及条件 题目答案及解析
稿件来源:高途
高中 | 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
常温下,用$\text{0} {.1000\;\rm mol/L\;NaH}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$标准溶液滴定$\text{100\;\rm mL\;\rm Ba(OH}{{\text{)}}_{\text{2}}}$溶液,测得溶液的相对电导率$\sigma$及$\lg c \left( \text{B}{{\text{a}}^{\text{2+}}} \right)$随滴入$\text{NaH}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$标准溶液的体积$ {V}\left( \text{NaH}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}} \right)$的变化关系如图所示。已知$K_{\text{a1}}\left( \text{H}_{\text{2}}\text{C}_{\text{2}}\text{O}_{\text{4}}\right)\text{=1}\text{.0}\times\text{1}\text{0}^{-2}$、$K_{\text{a2}}\left( \text{H}_{\text{2}}\text{C}_{\text{2}}\text{O}_{\text{4}}\right)\text{=1}\text{.0}\times\text{1}\text{0}^{-4}$。下列说法正确的是$(\qquad)$
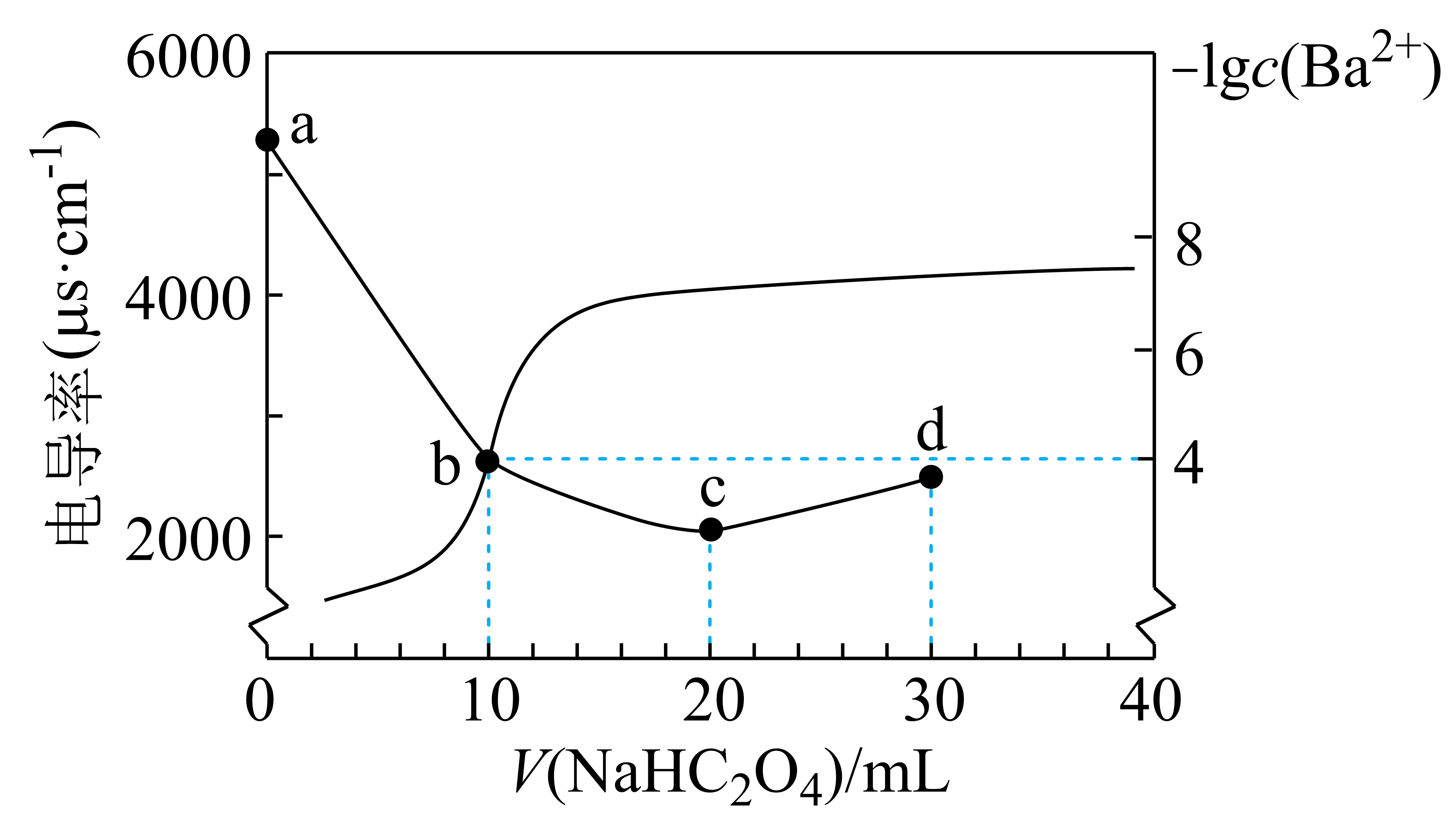
$\\rm c$点之后电导率持续上升说明,$\\text{H}{{\\text{C}}_{\\text{2}}}\\text{O}_{\\text{4}}^{-}$的导电能力强于$\\text{C}_{\\text{2}}\\text{O}_{\\text{4}}^{2-}$
","$\\rm\\text{b}\\to {c}$的过程中,溶液中$\\dfrac{c\\left( \\text{C}_{\\text{2}}\\text{O}_{\\text{4}}^{2-}\\right)c\\left( \\text{H}^{+}\\right)}{c\\left( \\text{H}_{\\text{2}}\\text{C}_{\\text{2}}\\text{O}_{\\text{4}}\\right)}$逐渐增大
","$\\rm c$点溶液中${c}\\left( \\text{B}{{\\text{a}}^{\\text{2+}}} \\right)$约为$\\text{1}\\text{.2}\\times\\text{1}\\text{0}^{-6}\\text{ mol/L}$
","$\\rm d$点溶液中:$c\\left( \\text{N}\\text{a}^{+}\\right)\\gt c\\left( \\text{H}\\text{C}_{\\text{2}}\\text{O}_{\\text{4}}^{-}\\right)\\gt c\\left( \\text{C}_{\\text{2}}\\text{O}_{\\text{4}}^{2-}\\right)\\gt c\\left( \\text{O}\\text{H}^{-}\\right)\\gt c\\left( \\text{H}^{+}\\right)$
"]从图中可知,$\rm a$到$\rm c$的过程中,溶液的电导率逐渐减小,则溶液中离子浓度逐渐减小,结合两种反应物可知,$\rm a$到$\rm b$段发生反应的方程式为$\rm NaHC_{2}O_{4}+Ba(OH)_{2}=BaC_{2}O_{4}↓+NaOH+H_{2}O$此时,钡离子沉淀完全,加入$\rm NaHC_{2}O_{4}$体积为$\rm 10\;\rm mL$,物质的量为$\rm 0.001\;\rm mol$,则生成氢氧化钠$\rm 0.001\;\rm mol$,$\rm b$到$\rm c$段随着$\rm NaHC_{2}O_{4}$的继续加入,是$\rm NaOH$与$\rm NaHC_{2}O_{4}$反应生成草酸钠和水,化学方程式为$\rm NaHC_{2}O_{4}+NaOH=Na_{2}C_{2}O_{4}+H_{2}O$。此时生成草酸钠物质的量为$\rm 0.001\;\rm mol$。$\rm c$到$\rm d$段加入$\rm NaHC_{2}O_{4}$后不发生反应。加入的$\rm NaHC_{2}O_{4}$的物质的量为$\rm 0.001\;\rm mol$。
$\rm A$.观察电导率曲线可知,过了$\rm {c}$点后继续加入草酸氢钠溶液时,溶液中实际上是有更多的$\rm N{{a}^{+}}$、$\rm {{\text{H}}^{+}}$等离子参加导电,并不单纯是因为$\rm H{{C}_{2}}\text{O}_{4}^{-}$的导电能力比$\rm {{\text{C}}_{2}}\text{O}_{4}^{2-}$强所致,$\rm A$错误;
$\rm B$.${{{K}}_{\text{a}1}}=\dfrac{{c}(\text{H}{{\text{C}}_{2}}\text{O}_{4}^{-})\cdot {c}({{\text{H}}^{+}})}{{c}({{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}})}$,${{{K}}_{\text{a}2}}=\dfrac{{c}({{\text{C}}_{2}}\text{O}_{4}^{2-})\cdot {c}({{\text{H}}^{+}})}{{c}(\text{H}{{\text{C}}_{2}}\text{O}_{4}^{-})}$,相乘可得${{{K}}_{\text{a}1}}\times {{{K}}_{\text{a}2}}=\dfrac{{c}({{\text{C}}_{2}}\text{O}_{4}^{2-})\cdot {{{c}}^{2}}({{\text{H}}^{+}})}{{c}({{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}})}$。题干所给的比值$\dfrac{c\left( \text{C}_{\text{2}}\text{O}_{\text{4}}^{2-}\right)c\left( \text{H}^{+}\right)}{c\left( \text{H}_{\text{2}}\text{C}_{\text{2}}\text{O}_{\text{4}}\right)}$可化为$\dfrac{\left( {{{K}}_{\text{a}1}}{{{K}}_{\text{a}2}} \right)}{{c}({{\text{H}}^{+}})}$,$\rm b$到$\rm c$点过程中氢氧化钠逐渐被消耗,碱性逐渐减弱,氢离子浓度逐渐增大,则在该过程中该比值应减小而非增大,$\rm B$错误;
$\rm C$.根据分析,$\rm b$点溶液中溶质为$\rm NaOH$和少量$\rm BaC_{2}O_{4}$,此时的溶液为$\rm BaC_{2}O_{4}$的饱和溶液,根据$\rm b$点钡离子浓度为$\rm 10^{-4}\;\rm mol/L$,可求得$K\rm _{sp}(BaC_{2}O_{4})=10^{-8}$,$\rm c$点溶液中草酸根离子的物质的量为$\rm 0.001\;\rm mol$,浓度为$\dfrac{0.001\;\rm \text{mol}}{0.12\text{ L}}$,则${ c(\rm Ba^{2+})}=\dfrac{{{{K}}_{\text{sp}}}(\text{Ba}{{\text{C}}_{2}}{{\text{O}}_{4}})}{ {c(}{{\text{C}}_{2}}\text{O}_{4}^{2-}\text{)}}=\dfrac{{{10}^{-8}}}{\dfrac{0.001}{0.12}}=1.2\times {{10}^{-6}}\;\rm mol/L$,$\rm C$正确;
$\rm D$.根据前述分析,$\rm d$点溶液中溶质为$\rm Na_{2}C_{2}O_{4}$和$\rm NaHC_{2}O_{4}$,且两者的物质的量均为$\rm 0.001\;\rm mol$,即两者的浓度相等(暂不考虑水解和电离),根据草酸一、二两级电离常数可知,草酸根离子的水解平衡常数为$\dfrac{{{{K}}_{\text{w}}}}{{{{K}}_{\text{a}2}}}={{10}^{-10}}$,草酸氢根离子的水解常数为$\rm 10^{-12}$,即草酸氢根离子的电离程度远大于草酸根和草酸氢根离子的水解程度,则溶液中$ c({{\text{C}}_{2}}\text{O}_{4}^{2-} )\gt c(\text{H}{{\text{C}}_{2}}\text{O}_{4}^{-}\rm )$,$\rm D$错误。
故选:$\rm C$
高中 | 导电的原因及条件题目答案及解析(完整版)
