高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
常温下,向某浓度${{\text{H}}_{\text{2}}}\text{A}$溶液中逐滴加入已知浓度的$\rm NaOH$溶液,溶液中$\text{p}c \left( {x} \right) [\text{p}c \left( {x} \right)=-\lg {c}\left( {x} \right)$,$x$为${{\text{H}}_{\text{2}}}\text{A}$、$\text{H}{{\text{A}}^{-}}$、${{\text{A}}^{2-}}\rm ]$与溶液$\rm pH$的变化关系如图所示。则下列说法正确的是$(\qquad)$
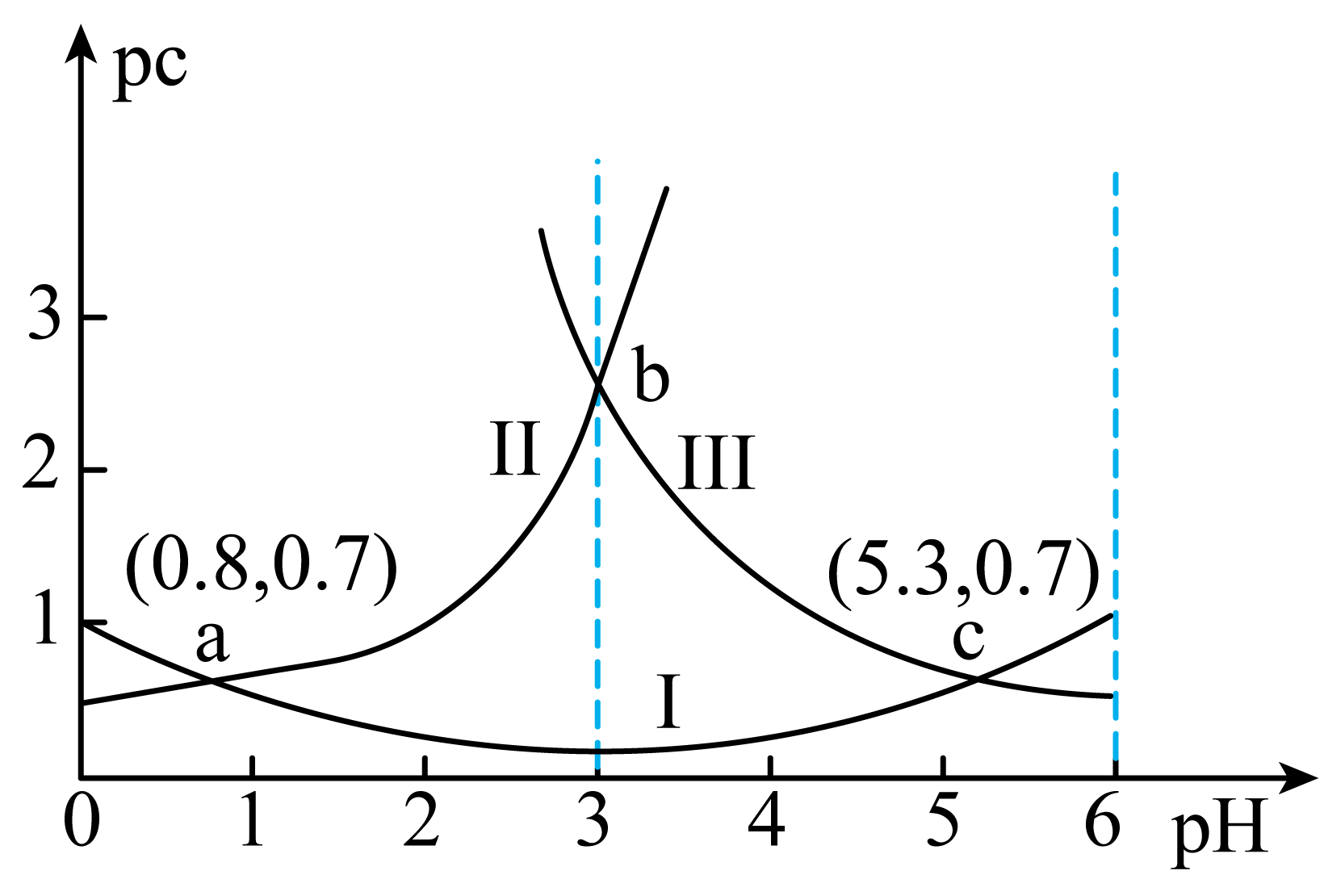
曲线Ⅱ代表$\\text{p}c\\left( \\text{H}{{\\text{A}}^{-}} \\right)$随着$\\rm pH$的变化曲线
","$\\rm c$点溶液中${c}\\left( \\text{N}{{\\text{a}}^{+}} \\right)\\gt 3{c}\\left( {{\\text{A}}^{2-}} \\right)$
","$\\rm b$点为曲线$\\rm II$与曲线$\\rm III$的交点,$\\rm b$点对应的$\\rm pH$为$\\rm 3.05$
","$\\rm pH$由$\\rm 0.8$增大到$\\rm 5.3$的过程中,水的电离程度先增大后减小
"]结合图象可知,随着$\rm pH$增大,曲线$\rm I$的${\rm p}c$值先减小后升高,随着溶液酸性变小,${c}\left( {{\text{H}}_{\text{2}}}\text{A} \right)$减小,即$\text{p}c\left( {{\text{H}}_{\text{2}}}\text{A} \right)$增大,${c}\left( \text{H}{{\text{A}}^{-}} \right)$先增大,当溶液酸性减小到一定程度时,$\text{H}{{\text{A}}^{-}}$转化为${{\text{A}}^{2-}}$,${c}\left( \text{H}{{\text{A}}^{-}} \right)$减小,${c}\left( {{\text{A}}^{2-}} \right)$增大,即$\text{p}c\left( \text{H}{{\text{A}}^{-}} \right)$先减小后增大,$\text{p}c\left( {{\text{A}}^{2-}} \right)$减小,故图象中曲线$\rm I$表示$\text{H}{{\text{A}}^{-}}$,曲线$\rm II$表示$\text{H}_{\text{2}}^{{}}\text{A}$,曲线$\rm III$表示${{\text{A}}^{2-}}$。根据$\rm I$、$\rm II$交点可以求出二元弱酸的${{{K}}_{\text{a1}}}=\dfrac{c\text{(H}{{\text{A}}^{-}} {)c(}{{\text{H}}^{+}}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{A)}}\text{=1}{{\text{0}}^{\text{-0}\text{.8}}}$,根据$\rm II$、$\rm III$交点可以求出二元弱酸的${{{K}}_{\text{a2}}}=\dfrac{c\text{(}{{\text{A}}^{2-}} {)c(}{{\text{H}}^{+}}\text{)}}{c\text{(H}{{\text{A}}^{-}}\text{)}}\text{=1}{{\text{0}}^{\text{-5}\text{.3}}}$。据此分析解答:
$\rm A$.据分析,曲线$\rm II$代表$\text{p}c\left( {{\text{H}}_{\text{2}}}\text{A} \right)$随着$\rm pH$的变化,故$\rm A$错误;
$\rm B$.$\rm c$点为曲线$\rm III$与曲线$\rm I$的交点,即为等浓度$\text{NaHA}$、$\text{N}{{\text{a}}_{\text{2}}}\text{A}$的混合溶液,即${c}\left( \text{N}{{\text{a}}_{\text{2}}}\text{A} \right) {=c}\left( \text{NaHA} \right)$,根据物料守恒可得$ {2c}\left( \text{N}{{\text{a}}^{+}} \right)\text{=3}\left[ {c}\left( {{\text{A}}^{\text{2-}}} \right) {+c}\left( \text{H}{{\text{A}}^{-}} \right) \right] {=6c}\left( {{\text{A}}^{\text{2-}}} \right)$,所以${c}\left( \text{N}{{\text{a}}^{+}} \right) {=3c}\left( {{\text{A}}^{\text{2-}}} \right)$,故$\rm B$错误;
$\rm C$.$\rm b$点为曲线$\rm II$与曲线$\rm III$的交点,${c}\left( {{\text{H}}_{\text{2}}}\text{A} \right) {=c}\left( {{\text{A}}^{\text{2-}}} \right)$,根据分析可知,在常温下$\text{H}_{\text{2}}^{{}}\text{A}$的${{{K}}_{\text{a1}}}=\dfrac{c\text{(H}{{\text{A}}^{-}} {)c(}{{\text{H}}^{+}}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{A)}}\text{=1}{{\text{0}}^{\text{-0}\text{.8}}}$、${{{K}}_{\text{a2}}}=\dfrac{c\text{(}{{\text{A}}^{2-}}{)c(}{{\text{H}}^{+}}\text{)}}{c\text{(H}{{\text{A}}^{-}}\text{)}}\text{=1}{{\text{0}}^{\text{-5}\text{.3}}}$,则${{{K}}_{\text{a1}}}{{{K}}_{\text{a2}}}=\dfrac{c\text{(H}{{\text{A}}^{-}} {)c(}{{\text{H}}^{+}}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{A)}}\times \dfrac{c\text{(}{{\text{A}}^{2-}} {)c(}{{\text{H}}^{+}}\text{)}}{c\text{(H}{{\text{A}}^{-}}\text{)}}=\dfrac{c\text{(}{{\text{A}}^{2-}}\text{)}{{{c}}^{2}}\text{(}{{\text{H}}^{+}}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{A)}}$,$\rm b$点时${c}\left( {{\text{H}}_{\text{2}}}\text{A} \right) {=c}\left( {{\text{A}}^{\text{2-}}} \right)$,则${{{K}}_{\text{a1}}}{{{K}}_{\text{a2}}}={{{c}}^{2}}\text{(}{{\text{H}}^{+}}\text{)}={{10}^{-0.8}}\times {{10}^{-5.3}}={{10}^{-6.1}}$,解得$c\text{(}{{\text{H}}^{+}}\text{)=1}{{\text{0}}^{\text{-3}\text{.05}}}\text{ mol/L}$,则$\rm b$点溶液$\text{pH=3}\text{.05}$,故$\rm C$正确;
$\rm D$.溶质完全为$\text{N}{{\text{a}}_{\text{2}}}\text{A}$时,水的电离程度最大,此时${c}\left( {{\text{A}}^{\text{2-}}} \right)\gt {c}\left( \text{H}{{\text{A}}^{-}} \right)\gt {c}\left( {{\text{H}}_{\text{2}}}\text{A} \right)$,所以$\rm pH$由$\rm 0.8$增大到$\rm 5.3$的过程中,水的电离程度持续增大,故$\rm D$错误。
故选:$\rm C$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
