高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
常温下,在柠檬酸$\left( {{\text{H}}_{\text{3}}}\text{R} \right)$和$\text{Cd}{{\left( \text{N}{{\text{O}}_{\text{3}}} \right)}_{\text{2}}}$混合液中滴加$\rm KOH$溶液。$\rm X$代表${c}\left( \text{C}{{\text{d}}^{\text{2+}}} \right)$、${c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right){/c}\left( {{\text{H}}_{\text{3}}}\text{R} \right)$、${c}\left( \text{H}{{\text{R}}^{{2-}}} \right){/c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)$、${c}\left( {{\text{R}}^{ {3-}}} \right){/c}\left( \text{H}{{\text{R}}^{{2-}}} \right)$。混合液中$\text{pX}\left[ \text{pX}=-\lg \rm X \right]$与$\rm pH$的关系如图所示。
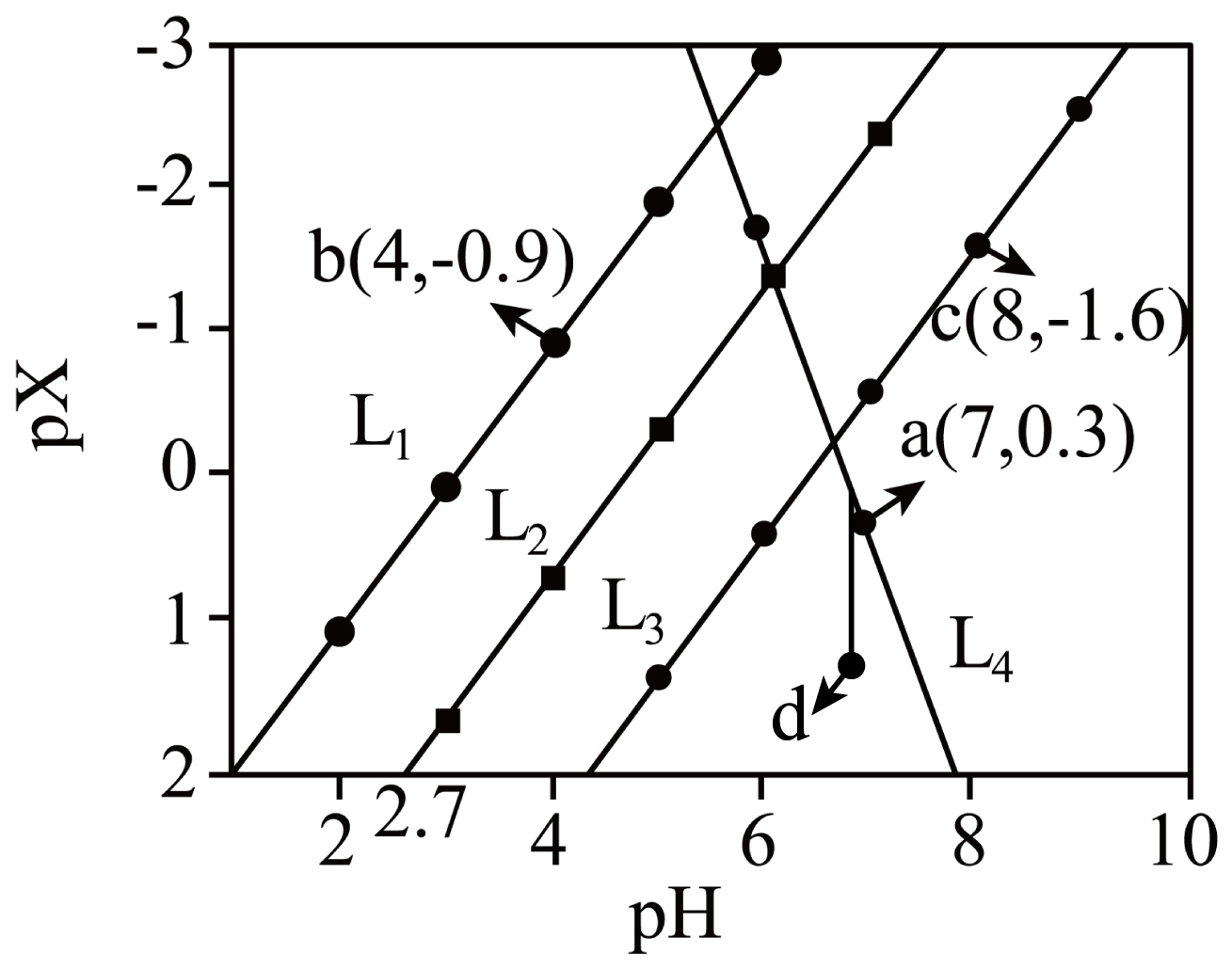
下列说法不正确的是$(\qquad)$
$\\rm L_{1}$直线表示$\\text{p}\\left[ {c}\\left( {{\\text{H}}_{\\text{2}}}{{\\text{R}}^{-}} \\right){/c}\\left( {{\\text{H}}_{\\text{3}}}\\text{R} \\right) \\right]$与$\\rm pH$关系
","$\\text{0}\\text{.1 mol/L K}{{\\text{H}}_{\\text{2}}}\\text{R}$溶液呈碱性
","$\\rm b$点的溶液中:$2c\\left( \\text{C}{{\\text{d}}^{\\text{2+}}} \\right)+c\\left( {{\\text{K}}^{+}} \\right)+c\\left( {{\\text{H}}^{+}} \\right)=c\\left( \\text{N} {\\text{O}}_{\\text{3}} ^{-} \\right)+c\\left( {{\\text{H}}_{\\text{2}}}{{\\text{R}}^{-}} \\right)+2c\\left( \\text{H}{{\\text{R}}^{ {2-}}} \\right)+3c\\left( {{\\text{R}}^{ {3-}}} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
","$\\rm d$点的溶液中无$\\text{Cd}{{\\left( \\text{OH} \\right)}_{\\text{2}}}$沉淀
"]$\text{Cd}{{\left( \text{N}{{\text{O}}_{\text{3}}} \right)}_{\text{2}}}$的溶液中滴加$\rm KOH$溶液生成$\rm Cd(OH)_{2}$沉淀,$\rm pH$越大,${c}\left( \text{C}{{\text{d}}^{\text{2+}}} \right)$越小,其对应的$\text{pX}\left[ \text{pX}=-\text{lgX} \right]$越大,故$\rm L_{4}$是代表${c}\left( \text{C}{{\text{d}}^{\text{2+}}} \right)$与$\rm pH$的关系;柠檬酸($\rm {{\operatorname{H}}_{3}}R$)是三元弱酸,与碱反应逐渐转为$\rm H_{2}R^{-}$、$\rm HR^{2-}$、$\rm R^{3-}$,酸的三步电离平衡常数${{K}_\rm {a1}}\gg {{K}_\rm {a2}}\gg {{K}_\rm {a3}}$,故$\rm X$代表$\dfrac{{c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)}{{c}\left( {{\text{H}}_{\text{3}}}\text{R} \right)}$、$\dfrac{{c}\left( \text{H}{{\text{R}}^{2}}^{-} \right)}{{c}\left( {{\text{H}}_{2}}{{\text{R}}^{-}} \right)}$、$\dfrac{{c}\left( {{\text{R}}^{3-}} \right)}{{c}\left( \text{H}{{\text{R}}^{2-}} \right)}$,分别乘以$ c\rm (H^{+})$,可以转化为平衡常数的表达式,根据大小可知,由题意${{\text{L}}_{\text{1}}}$、${{\text{L}}_{\text{2}}}$、${{\text{L}}_{\text{3}}}$分别代表$\dfrac{{c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)}{{c}\left( {{\text{H}}_{\text{3}}}\text{R} \right)}$、$\dfrac{{c}\left( \text{H}{{\text{R}}^{2}}^{-} \right)}{{c}\left( {{\text{H}}_{2}}{{\text{R}}^{-}} \right)}$、$\dfrac{{c}\left( {{\text{R}}^{3-}} \right)}{{c}\left( \text{H}{{\text{R}}^{2-}} \right)}$。
$\rm A$.由题意可知,${{\text{L}}_{\text{1}}}$、${{\text{L}}_{\text{2}}}$、${{\text{L}}_{\text{3}}}$和${{\text{L}}_{\text{4}}}$分别代表$\dfrac{{c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)}{{c}\left( {{\text{H}}_{\text{3}}}\text{R} \right)}$、$\dfrac{{c}\left( \text{H}{{\text{R}}^{2}}^{-} \right)}{{c}\left( {{\text{H}}_{2}}{{\text{R}}^{-}} \right)}$、$\dfrac{{c}\left( {{\text{R}}^{3-}} \right)}{{c}\left( \text{H}{{\text{R}}^{2-}} \right)}$和${c}\left( \text{C}{{\text{d}}^{\text{2+}}} \right)$,$\rm A$正确;
$\rm B$.由题意${{\text{L}}_{\text{1}}}$、${{\text{L}}_{\text{2}}}$、${{\text{L}}_{\text{3}}}$分别代表$\dfrac{{c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)}{{c}\left( {{\text{H}}_{\text{3}}}\text{R} \right)}$、$\dfrac{{c}\left( \text{H}{{\text{R}}^{2}}^{-} \right)}{{c}\left( {{\text{H}}_{2}}{{\text{R}}^{-}} \right)}$、$\dfrac{{c}\left( {{\text{R}}^{3-}} \right)}{{c}\left( \text{H}{{\text{R}}^{2-}} \right)}$。将$\rm b$($\rm 4$,$\rm -0.9$)带入酸的第一步表达式$K_{\rm a1}=\dfrac{{c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)\times {c(}{{\text{H}}^{+}}\text{)}}{{c}\left( {{\text{H}}_{\text{3}}}\text{R} \right)}\rm =10^{0.9}\times 10^{-4}=10^{-3.1}$,同理,将($\rm 2.7$,$\rm 2$)代入酸的第二步电离表达式得到$ K_\rm {a2}=10^{-4.7}$,将$\rm c$($\rm 8$,$\rm -1.6$)代入酸的第三步表达式得到$ K_\rm {a3}=10^{-6.4}$,则${{\text{H}}_{\text{3}}}\text{R}$的${{ {K}}_{\text{a}}}$依次为${{10}^{-3.1}}$、${{10}^{-4.7}}$、${{10}^{-6.4}}$,$\text{K}{{\text{H}}_{\text{2}}}\text{R}$是酸式盐,$\rm H_{2}R^{-}$能水解使溶液呈碱性,水解平衡常数为$ K_{\rm h3}=\dfrac{{{ {K}}_{\text{w}}}}{{{ {K}}_{\text{a1}}}}=\dfrac{1\times {{10}^{-14}}}{{{10}^{-3.1}}}={{10}^{-10.9}}$,也能电离使溶液呈酸性,电离常数为$ K_\rm {a2}=10^{-4.7}$,通过比较,电离程度大于水解程度,溶液呈酸性,$\rm B$错误;
$\rm C$.$\rm b$点含$\rm KNO_{3}$、$\text{K}{{\text{H}}_{\text{2}}}\text{R}$溶液,电荷守恒:$2c\left( \text{C}{{\text{d}}^{\text{2+}}} \right)+c\left( {{\text{K}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)=c\left( \text{N} {\text{O}}_{\text{3}} ^{-} \right)+c\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)+2c\left( \text{H}{{\text{R}}^{{2-}}} \right)+3c\left( {{\text{R}}^{{3-}}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$, $\rm C$正确;
$\rm D$.$\rm a$点可计算$ K_\rm {sp}$,$\rm d$点在线下,通过计算可知:$\rm d$点${Q}\lt {{K}_\rm {sp}}$,所以没有$\text{Cd}{{\left( \text{OH} \right)}_{\text{2}}}$沉淀,$\rm D$正确。
故选:$\rm B$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
