高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
在一定温度下,向某非水溶剂$\rm ($自身不电离$\rm )$中加入指示剂$\rm HIn$的钾盐$\rm KIn(KIn$完全电离,$\rm HIn$的电离常数${{K}_{\text{a}}}(\text{HIn})=3.6\times {{10}^{-20}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\rm )$,再向该溶液中加入一元弱酸$\rm HX$或$\rm HY$,均发生反应$\rm \text{I}{{\text{n}}^{-}}\text{+HA}\rightleftharpoons {{\text{A}}^{-}}\text{+HIn}\rm (A$代表$\rm X$或$\rm Y)$。保持$\rm KIn$的起始量$\rm {{\textit{n}}_{\text{0}}}\text{(KIn)}$不变,平衡时测得$ \dfrac{c(\text{I}{{\text{n}}^{-}})}{c(\text{HIn})}$与$\rm \dfrac{\textit{n}(HA)}{{{\textit{n}}_{\text{0}}}\text{(KIn)}}\rm [\textit{n}(HA)$代表加入的$\rm HA$的物质的量$\rm ]$的关系如图所示。下列说法错误的是$\rm (\qquad)$
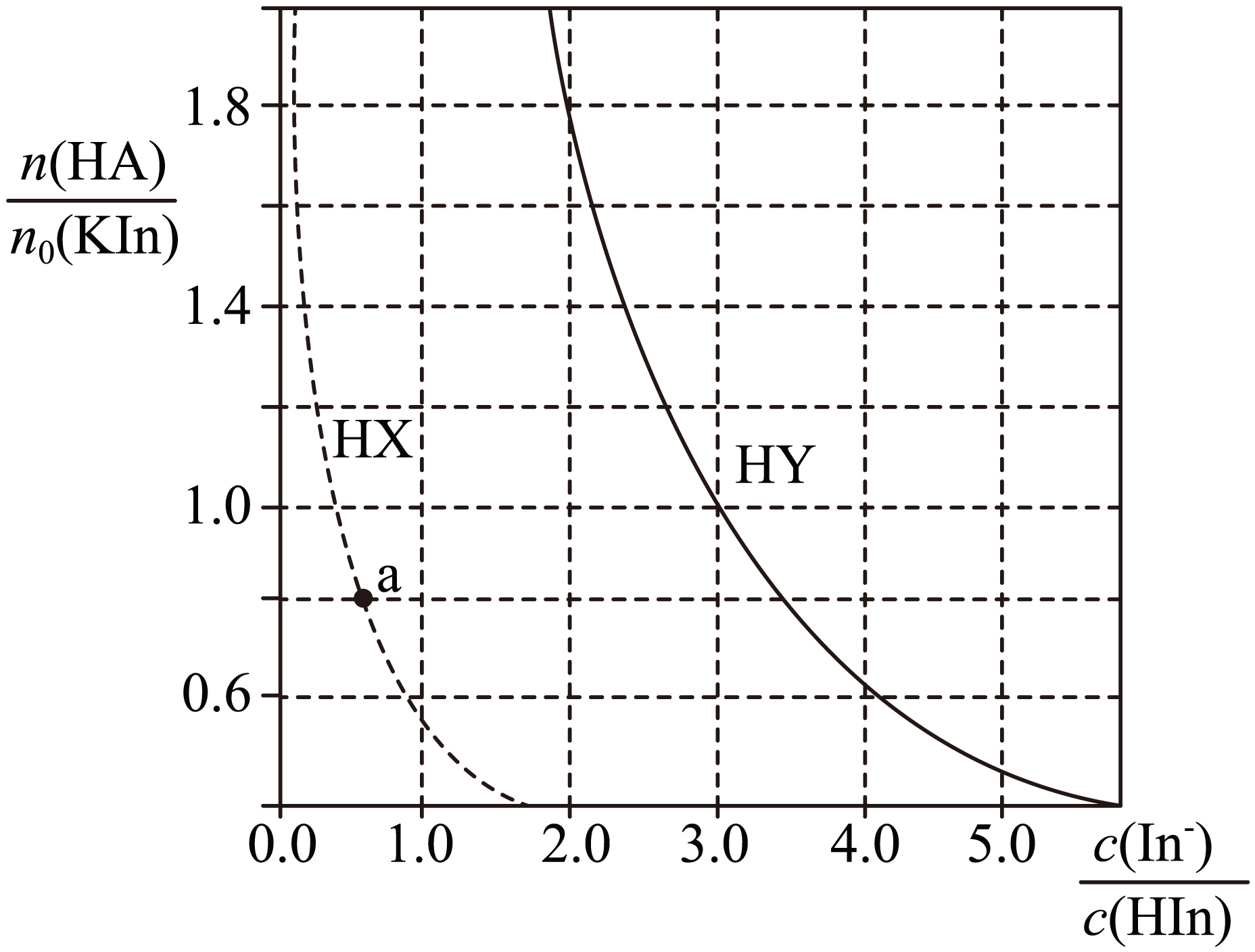
$\\rm a$点:$c(\\text{HIn})+c({{\\text{H}}^{+}})=c({{\\text{X}}^{-}})$
","用该溶剂分别配制等浓度的$\\rm HX$和$\\rm HY$溶液,电离度:$\\rm \\alpha (\\text{HX})\\lt \\alpha (\\text{HY})$
","$c({{\\text{H}}^{+}})=1.8\\times {{10}^{-20}}\\;\\rm \\text{mol}\\cdot {{\\text{L}}^{-1}}$时,$ c(\\text{HY})+c({{\\text{Y}}^{-}})\\gt c(\\text{HIn})+c(\\text{I}{{\\text{n}}^{-}})$
","反应$\\rm \\text{I}{{\\text{n}}^{-}}\\text{+HY}\\rightleftharpoons {{\\text{Y}}^{-}}\\text{+HIn}$的平衡常数为$\\rm \\dfrac{1}{9}$
"]$\rm A$.向$\rm KIn$该溶液中一元弱酸$\rm HX$,发生反应$\rm \text{I}{{\text{n}}^{-}}\text{+HX}\rightleftharpoons {{\text{X}}^{-}}\text{+HIn}$、$\rm \text{HX}\rightleftharpoons {{\text{X}}^{-}}+{{\text{H}}^{+}}$,由系数关系可知,$\rm a$点时溶液中$ c(\text{HIn})+c({{\text{H}}^{+}})=c({{\text{X}}^{-}})$,$\rm A$正确;
$\rm B$.由图可知,当$\dfrac{c(\text{I}{{\text{n}}^{-}})}{c(\text{HIn})}$相等时,$\rm HX$的$ \dfrac{\textit{n}\rm(HX)}{{{\textit{n}}_{\text{0}}}\text{(KIn)}}$更小,说明生成等物质的量$\rm HIn$,消耗$\rm HX$的物质的量更小,说明$\rm HX$的酸性更强,电离程度更大,则用该溶剂分别配制等浓度的$\rm HX$和$\rm HY$溶液,电离度:$ \alpha (\text{HX})\gt \alpha (\text{HY})$,$\rm B$错误;
$\rm C$.$\rm HIn$的电离常数$ {{K}_{\text{a}}}(\text{HIn})=3.6\times {{10}^{-20}}\text{ mol}\cdot {{\text{L}}^{-1}}$,$c({{\text{H}}^{+}})=1.8\times {{10}^{-20}}\text{ mol}\cdot {{\text{L}}^{-1}}$时,$\rm \dfrac{\textit{c}(I{{\text{n}}^{-}}\text{)}}{\textit{c}(HIn)}=\dfrac{{{\textit{K}}_{\text{a}}}\text{(HIn)}}{\textit{c}\left( {{\text{H}}^{+}} \right)}=\dfrac{3.6\times {{10}^{-20}}}{1.8\times {{10}^{-20}}\text{ }}\text{ =}2$,由图可知,此时$\rm \dfrac{\textit{n}(HY)}{{{\textit{n}}_{\text{0}}}\text{(KIn)}}\rm \gt 1$,根据物料守恒可知,$c(\text{HY})+c({{\text{Y}}^{-}})\gt c(\text{HIn})+c(\text{I}{{\text{n}}^{-}})$,$\rm C$正确;
$\rm D$.由图可知,当$\dfrac{c(\text{I}{{\text{n}}^{-}})}{c(\text{HIn})}\rm =3.0$时,$\rm \dfrac{\textit{n}(HY)}{{{\textit{n}}_{\text{0}}}\text{(KIn)}}\rm =1.0$,溶液中$ c(\text{HY})+c({{\text{Y}}^{-}})=c(\text{HIn})+c(\text{I}{{\text{n}}^{-}})$,反应$\rm \text{I}{{\text{n}}^{-}}\text{+HY}\rightleftharpoons {{\text{Y}}^{-}}\text{+HIn}$的平衡常数为$\rm \dfrac{\textit{c}\left( {{\text{Y}}^{-}} \right)\textit{c}\left( \text{HIn} \right)}{\textit{c}\left( \text{I}{{\text{n}}^{-}} \right)\textit{c}\left( \text{HY} \right)}=\dfrac{\textit{c}\left( \text{HIn} \right)}{\textit{c}\left( \text{I}{{\text{n}}^{-}} \right)}\times \dfrac{\textit{c}\left( {{\text{Y}}^{-}} \right)}{\textit{c}\left( \text{HY} \right)}\rm =\dfrac{1}{3}\times \dfrac{1}{3}=\dfrac{1}{9}$,$\rm D$正确;
故选:$\rm B$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
