高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
银饰用久了表面会有一层 $\text{A}{{\text{g}}_{2}}\text{S}$ 而发黑,将银饰与 $\text{Al}$ 片接触并加入 $\text{NaCl}$ 溶液,发生原电池反应可以除去银饰表面的 $\text{A}{{\text{g}}_{2}}\text{S}$。下列说法不正确的是 $(\qquad)$
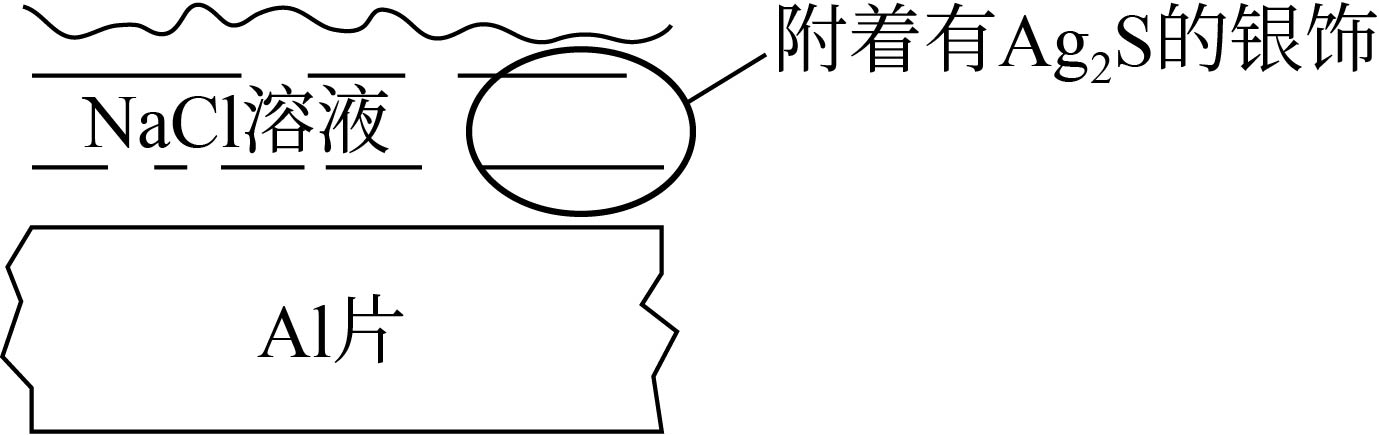
$\\rm Al$ 片作原电池的负极
","溶液中钠离子向银饰极移动
","电子由负极经 $\\rm NaCl$ 溶液流向正极
","$\\text{A}{{\\text{g}}_{2}}\\text{S}$ 表面发生反应:$\\text{A}{{\\text{g}}_{2}}\\text{S}+2{{\\text{e}}^{-}}\\xlongequal []{\\ \\ \\ \\ }2\\text{Ag}+{{\\text{S}}^{2-}}$
"]由图可知,除去银饰表面硫化银的装置为原电池,铝片是原电池的负极,铝失去电子发生氧化反应,银饰为正极,硫化银在正极得到电子发生还原反应。
$\rm A$.由分析可知,铝片是原电池的负极,铝失去电子发生氧化反应,故$\rm A$正确;
$\rm B$.由分析可知,铝片是原电池的负极,银饰为正极,原电池工作时,阳离子向正极银饰移动,故$\rm B$正确;
$\rm C$.电子由负极流出,但不能经氯化钠溶液流向正极,故$\rm C$错误;
$\rm D$.由分析可知,银饰为正极,则硫化银在正极得到电子发生还原反应生成银和硫离子,电极反应式为$\text{A}{{\text{g}}_{2}}\text{S}+2{{\text{e}}^{-}}=2\text{Ag}+{{\text{S}}^{2-}}$,故$\rm D$正确;
故选:$\rm C$
高中 | 原电池工作原理题目答案及解析(完整版)
