高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
用酸性甲醛燃料电池为电源进行电解装置如图所示,下列说法正确的是$(\quad\ \ \ \ )$
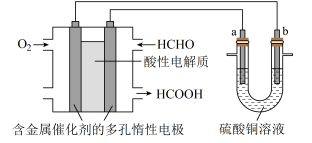
当 $\\rm a$、$\\rm b$ 都是铜时,电解的总反应方程式为:$2\\text{CuS}{{\\text{O}}_{4}}+2{{\\text{H}}_{2}}\\text{O}\\begin{matrix}\\underline{\\underline{电解}} \\\\{} \\\\\\end{matrix}2{{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}+2\\text{Cu}+{{\\text{O}}_{2}}\\uparrow $
","燃料电池工作时,正极反应为:${{\\text{O}}_{2}}+2{{\\text{H}}_{2}}\\text{O}+4{{\\text{e}}^{-}}=4\\text{O}{{\\text{H}}^{-}}$
","当燃料电池消耗 $2.24\\ \\text{L}$ 甲醛气体时,电路中理论上转移 $0.2\\ \\text{mol}\\ {{\\text{e}}^{-}}$
","燃料电池工作时,负极反应为:$\\text{HCHO}+{{\\text{H}}_{2}}\\text{O}-2{{\\text{e}}^{-}}=\\text{HCOOH}+2{{\\text{H}}^{+}}$
"]左边装置是酸性甲醛燃料电池,原电池放电时,燃料失去电子发生氧化反应,所以通入燃料的电极为负极,通入氧气的电极为正极,正极上氧化剂得到电子发生还原反应,右边装置有外界电源,所以是电解池,连接负极的 $\rm a$ 电极是阴极,连接正极的 $\rm b$ 极是阳极,阳极上失去电子发生氧化反应,阴极上得到电子发生还原反应。
$\rm A$.当 $\rm a$、$\rm b$ 都是铜作电极时,形成电解精炼装置,阳极发生铜失去电子,阴极发生铜离子得到电子,$\rm A$错误;
$\rm B$.由于电解质溶液呈酸性,燃料电池正极反应为 ${{\text{O}}_{2}}+4{{\text{H}}^{+}}+4{{\text{e}}^{-}}=2{{\text{H}}_{2}}\text{O}$,$\rm B$错误;
$\rm C$.当燃料电池消耗 $\rm 2.24$ $\rm L$ 甲醛气体时,由于未说明是在标况下,所以无法计算甲醛的物质的量,则无法计算转移电子的物质的量,$\rm C$错误;
$\rm D$.燃料电池工作时,甲醛在负极上失去电子生成甲酸,则负极反应为 $\text{HCHO}+{{\text{H}}_{2}}\text{O}-2{{\text{e}}^{-}}=\text{HCOOH}+2{{\text{H}}^{+}}$,$\rm D$正确;
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
