高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
已知$\rm A$、$\rm B$、$\rm C$、$\rm D$、$\rm E$、$\rm G$是原子序数依次增大的六种短周期主族元素。常温下元素$\rm A$的单质分子由双原子构成,元素$\rm B$原子最外层电子数是次外层的$\rm 3$倍,元素$\rm D$原子的$\rm M$层电子数比$\rm K$层少$\rm 1$个,元素$\rm E$的简单离子在同周期中半径最小,$\rm G$与$\rm C$处于同一主族。回答下列问题:
元素$\rm B$在周期表中的位置为 。
第二周期第$\\rm VIA$族
"]]据分析,元素$\rm B$为氧元素,位于元素周期表第二周期第$\rm VIA$族;
如图是某同学设计的用浓盐酸和$\text{KMn}{{\text{O}}_{\text{4}}}$固体制取少量$\rm G$单质,并验证其氧化性比碘单质强的微型装置:
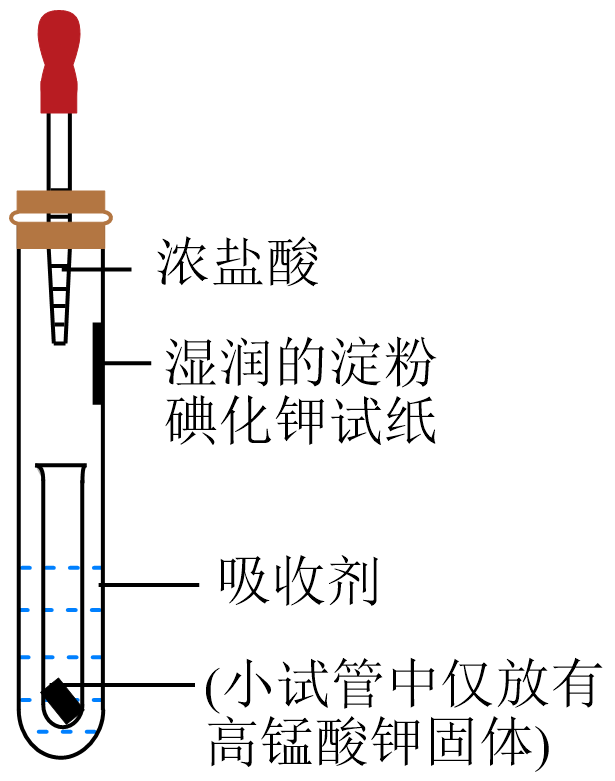
证明$\rm G$单质氧化性比碘单质强的实验现象是 ,从原子结构的角度解释是 ;装置生成$\rm G$单质的离子方程式为 。
湿润的淀粉碘化钾试纸变蓝;氯元素和碘元素同族,原子半径氯小于碘,氯原子得电子能力强于碘原子,所以氯气氧化性强于碘单质;$\\text{2MnO}_{4}^{-}+\\text{10C}{{\\text{l}}^{-}}+\\text{16}{{\\text{H}}^{+}}=\\text{2M}{{\\text{n}}^{2+}}+\\text{5C}{{\\text{l}}_{2}}\\uparrow +\\text{8}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]浓盐酸和$\text{KMn}{{\text{O}}_{\text{4}}}$固体发生氧化还原反应生成氯气,可将碘化钾中的$\rm I^{-}$氧化为$\rm I_{2}$,使湿润的淀粉碘化钾试纸变蓝;氯元素和碘元素同族,原子半径氯小于碘,氯原子得电子能力强于碘原子,所以氯气氧化性强于碘单质;浓盐酸和$\text{KMn}{{\text{O}}_{\text{4}}}$固体发生氧化还原反应生成氯气、氯化锰和水,离子方程式:$\text{2MnO}_{4}^{-}+\text{10C}{{\text{l}}^{-}}+\text{16}{{\text{H}}^{+}}=\text{2M}{{\text{n}}^{2+}}+\text{5C}{{\text{l}}_{2}}\uparrow +\text{8}{{\text{H}}_{\text{2}}}\text{O}$;
下列说法正确的是 $\rm ($填标号$\rm )$。
$\rm a$.元素$\rm A$、$\rm B$组成的化合物常温下一定呈气态
$\rm b$.元素$\rm D$、$\rm E$、$\rm G$的最高价氧化物对应的水化物两两之间均能发生反应
$\rm c$.离子半径:$\rm C\gt A$
$\rm d$.简单氢化物的稳定性:$\rm B\gt G$
$\\rm bd$
"]]$\rm a$.$\rm A$为氢元素或氮元素,$\rm B$为氧元素,二者组成的化合物常温下不一定是气态,故$\rm a$错误;
$\rm b$.元素$\rm D$、$\rm E$、$\rm G$分别为$\rm Na$、$\rm Al$、$\rm Cl$,最高价氧化物对应水化物分别是强碱氢氧化钠、两性氢氧化物氢氧化铝和强酸高氯酸,两两间可以发生反应,故$\rm b$正确;
$\rm c$.$\rm C$只能为氟元素,$\rm A$为氢元素或氮元素,离子电子层越多,离子半径越大,电子层相同,原子序数越大,离子半径越小,所以$\rm {{\text{F}}^{-}}\gt {{\text{H}}^{+}}$或$\rm {{\text{F}}^{-}}\lt {{\text{N}}^{3-}}$,故$\rm c$错误;
$\rm d$.非金属性:$\rm \text{O}\gt \text{Cl}$,简单氢化物的稳定性:$\rm {{\text{H}}_{\text{2}}}\text{O}\gt \text{HCl}$,故$\rm d$正确;
能证明元素$\rm D$的金属性强于元素$\rm E$的是 $\rm ($填标号$\rm )$。
$\rm a$.单质熔点:$\rm D\lt E$
$\rm b$.最高正价:$\rm D\lt E$
$\rm c$.最高价氧化物对应水化物的碱性:$\rm D\gt E$
$\\rm c$
"]]$\rm a$.单质熔点高低与元素的金属性无关,故$\rm a$错误;
$\rm b$.元素最高化合价与元素金属性无关,故$\rm b$错误;
$\rm c$.元素金属性越强,最高价氧化物对应水化物的碱性越强,$\rm NaOH$碱性强于$\rm Al(OH)_{3}$,证明金属性:$\rm \text{Na}\gt \text{Al}$,故$\rm c$正确。
高中 | 离子方程式题目答案及解析(完整版)
