高中 | 盐溶液中粒子浓度大小比较 题目答案及解析
稿件来源:高途
高中 | 盐溶液中粒子浓度大小比较题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液中粒子浓度大小比较
$\rm I$.$\rm 25\;\rm ^\circ\rm C$时,部分物质的电离平衡常数如表所示:
| 化学式 | $\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$ | ${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$ | ${{\text{H}}_{2}}\text{S}{{\text{O}}_{3}}$ | ${{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}$ |
| 电离平衡常数 | $1.8 \times 10^{-5}$ | ${{K}_{1}}=4.3\times {{10}^{-7}}$ ${{K}_{2}}=5.6\times {{10}^{-11}}$ | ${{K}_{1}}=1.4\times {{10}^{-2}}$ ${{K}_{2}}=6.0\times {{10}^{-8}}$ | ${{K}_{1}}=5.6\times {{10}^{-2}}$ ${{K}_{2}}=1.4\times {{10}^{-4}}$ |
在$\rm 25\;\rm ^\circ\rm C$条件下,请回答下列问题:
$\text{pH}=10$的$\text{NaOH}$溶液和$\text{pH}=10$的$\text{C}{{\text{H}}_{3}}\text{COONa}$溶液,设由水电离产生的$\text{O}{{\text{H}}^{-}}$的物质的量浓度分别为$c\left( \text{A} \right)$和$c\left( \text{B} \right)$,则$\dfrac{c\left( \text{A} \right)}{c\left( \text{B} \right)}=$ 。将上述两溶液分别稀释$\rm 10$倍,$\dfrac{c\left( \text{A} \right)}{c\left( \text{B} \right)}$的比值 $\rm ($填“变大”、“不变”或“变小”$\rm )$。
${{10}^{-6}}$;变大
"]]$\text{pH}=\text{1}0$的$\text{NaOH}$溶液中由水电离产生的$\text{O}{{\text{H}}^{-}}$的物质的量浓度为$c\left( \text{A} \right)=c\rm (H^{+})=10^{-10}\;\rm mol/L$,$\rm CH_{3}COONa$是强碱弱酸盐,醋酸根水解使溶液呈碱性,故$\text{pH}=\text{1}0$的$\text{C}{{\text{H}}_{3}}\text{COONa}$溶液由水电离产生的$\text{O}{{\text{H}}^{-}}$的物质的量浓度为$ {c}\left( \text{B} \right)=\dfrac{{{ {K}}_{\text{w}}}}{ {c}\left( {{\text{H}}^{+}} \right)}=\dfrac{{{10}^{-14}}}{{{10}^{-10}}}\rm \;mol/\text{L}={{10}^{-4}}\;\rm mol/L$,故$\dfrac{c\left( \text{A} \right)}{c\left( \text{B} \right)}\rm =10^{-6}$,将上述两溶液分别稀释$\rm 10$倍,$c\left( \text{A} \right)$增大变为$\rm 10^{-9}\;\rm mol/L$,而$c\left( \text{B} \right)$由于醋酸根浓度减小而变小,故$\dfrac{c\left( \text{A} \right)}{c\left( \text{B} \right)}$的比值变大;
向$\rm \text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液通入少量$\rm \text{S}{{\text{O}}_{2}}$反应的离子方程式为 。
$\\rm 2\\text{CO}_{3}^{2-}+{{\\text{H}}_{2}}\\text{O}+\\text{S}{{\\text{O}}_{2}}=2\\text{HCO}_{3}^{-}+\\text{SO}_{3}^{2-}$
"]]酸性:$\rm {{\text{H}}_{2}}S{{O}_{3}}\gt {{\text{H}}_{2}}C{{O}_{3}}\gt HSO_{3}^{-}\gt HCO_{3}^{-}$,向$\rm \text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液通入少量$\rm \text{S}{{\text{O}}_{2}}$,无二氧化碳气体放出,离子方程式为$\rm 2\text{CO}_{\text{3}}^{ {2-}}\rm +H_{2}O+SO_{2}=2\text{HCO}_{\text{3}}^{-}\rm +\text{SO}_{\text{3}}^{ {2-}}$;
$0.1\ \text{mol}\cdot {{\text{L}}^{-1}}$的$\text{NaH}{{\text{C}}_{2}}{{\text{O}}_{4}}$溶液中各离子浓度由大到小的顺序 。
$c\\left( \\text{N}{{\\text{a}}^{+}} \\right)\\gt c\\left( \\text{H}{{\\text{C}}_{2}}\\text{O}_{4}^{-} \\right)\\gt c\\left( {{\\text{H}}^{+}} \\right)\\gt c\\left( {{\\text{C}}_{2}}\\text{O}_{4}^{2-} \\right)\\gt c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
"]]$0. {1\;\rm mol}\cdot {{\text{L}}^{-1}}$的$\text{NaH}{{\text{C}}_{2}}{{\text{O}}_{4}}$溶液中,$\rm Na^{+}$不电离不水解,浓度最大,$\text{H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-}$会有小部分发生电离和水解,故浓度小于$\rm Na^{+}$,$\text{H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-}$电离产生等量的${{\text{C}}_{2}}\text{O}_{4}^{2-}$和$\rm H^{+}$,$\rm H^{+}$还有一个来源是$\rm H_{2}O$的电离,故$\rm H^{+}$的浓度略大于草酸根,$K_{\rm h2}{\rm(H_{2}C_{2}O_{4})}=\dfrac{{{{K}}_{\text{w}}}}{{{{K}}_{\text{a}1}}\left( {{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}} \right)}=\dfrac{{{10}^{-14}}}{5.6\times {{10}^{-2}}}\lt {{{K}}_{\text{a}2}}\left( {{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}} \right)$,$\text{NaH}{{\text{C}}_{2}}{{\text{O}}_{4}}$电离程度大于水解,溶液显酸性,$\rm OH^{-}$浓度最小,故各离子浓度由大到小的顺序为${c}\left( \text{N}{{\text{a}}^{+}} \right)\gt {c}\left( \text{H}{{\text{C}}_{\text{2}}}\text{O}_{4}^{-} \right)\gt {c}\left( {{\text{H}}^{+}} \right)\gt {c}\left( {{\text{C}}_{\text{2}}}\text{O}_{4}^{2-} \right)\gt {c}\left( \text{O}{{\text{H}}^{-}} \right)$;
$\rm I I$.$\text{S}{{\text{O}}_{2}}$是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。工业上用$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}}$吸收尾气中$\text{S}{{\text{O}}_{2}}$使之转化为$\text{NaHS}{{\text{O}}_{3}}$,再以$\text{S}{{\text{O}}_{2}}$为原料设计原电池,然后电解$\rm ($惰性电极$\rm )\text{NaHS}{{\text{O}}_{3}}$制取${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$,装置如下:
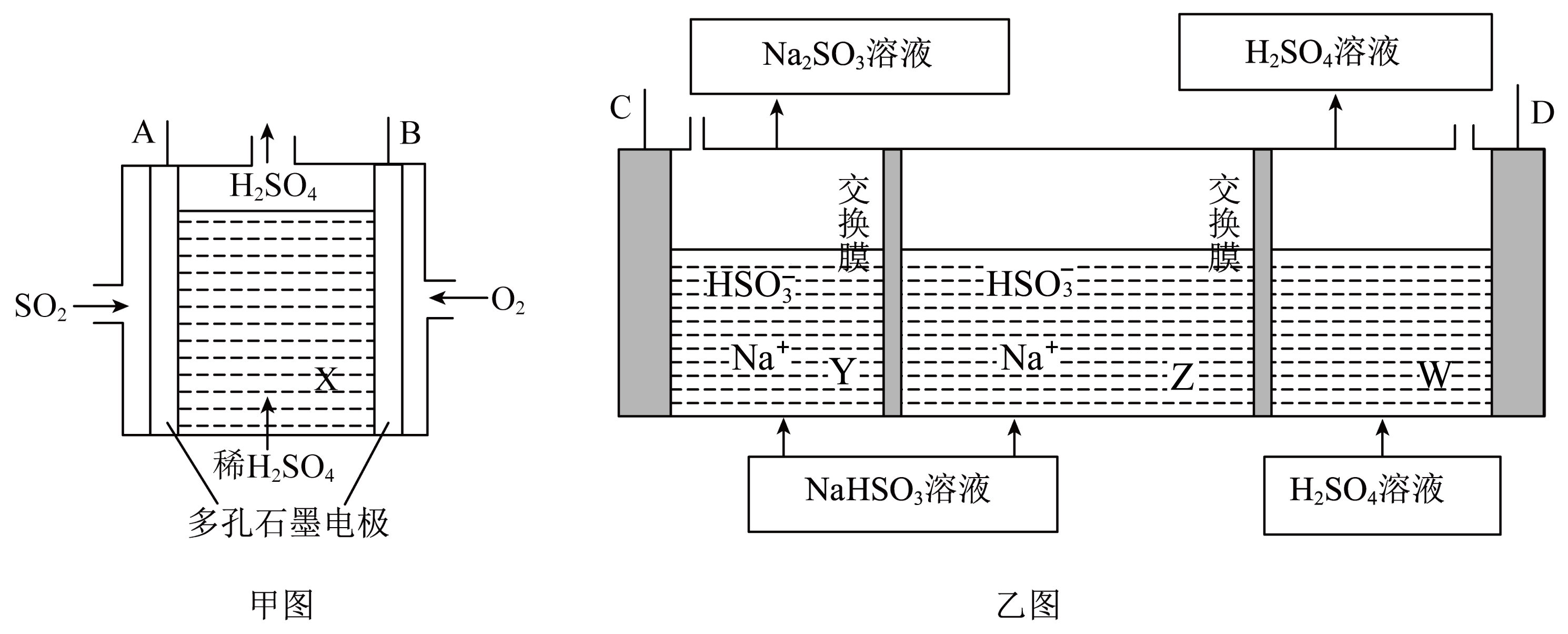
甲图中$\rm A$电极上的反应式为 。
$\\text{S}{{\\text{O}}_{2}}+2{{\\text{H}}_{2}}\\text{O}-2{{\\text{e}}^{-}}=4{{\\text{H}}^{+}}+\\text{SO}_{4}^{2-}$
"]]由分析可知,在甲图中的$\rm A$电极上,二氧化硫失去电子和水结合生成硫酸,电极反应式为$\rm SO_{2}+2H_{2}O-2e^{-}=4H^{+}+SO_{4}^{2-}$
甲图中$\rm B$与乙图 $\rm ($填“$\rm C$”或“$\rm D$”$\rm )$极相连,进行电解时乙图$\rm Z$中$\text{Na}{{}^{+}}$向 $\rm ($填“$\rm Y$”或“$\rm W$”$\rm )$中移动。
$\\rm D$;$\\rm Y$
"]]图甲中$\rm A$为负极,$\rm B$为正极,乙图中$\rm C$极是阴极,所以连接电源的负极,即$\rm C$连接$\rm A$,所以$\rm B$连接$\rm D$;进行电解时图乙$\rm Z$中钠离子向阴极移动,即向$\rm Y$中移动;
乙图阳极的电极反应式为 。
$\\text{HSO}_{3}^{-}+{{\\text{H}}_{2}}\\text{O}-2{{\\text{e}}^{-}}=\\text{SO}_{4}^{2-}+3{{\\text{H}}^{+}}$
"]]由分析可知,阳极的反应为$\rm HSO_{3}^{-}\rm -2e^{-}+H_{2}O=SO_{4}^{2-}\rm +3H^{+}$。
高中 | 盐溶液中粒子浓度大小比较题目答案及解析(完整版)
