高中 | 盐溶液中粒子浓度大小比较 题目答案及解析
稿件来源:高途
高中 | 盐溶液中粒子浓度大小比较题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液中粒子浓度大小比较
常温下,用某未知浓度的盐酸滴定$15.00\ \text{mL }0.5000\ \text{mol}\cdot {{\text{L}}^{-1}}\text{ N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液,其滴定曲线如图所示。已知图像中$\rm EG$段有大量气泡产生,下列有关说法正确的是$(\qquad)$
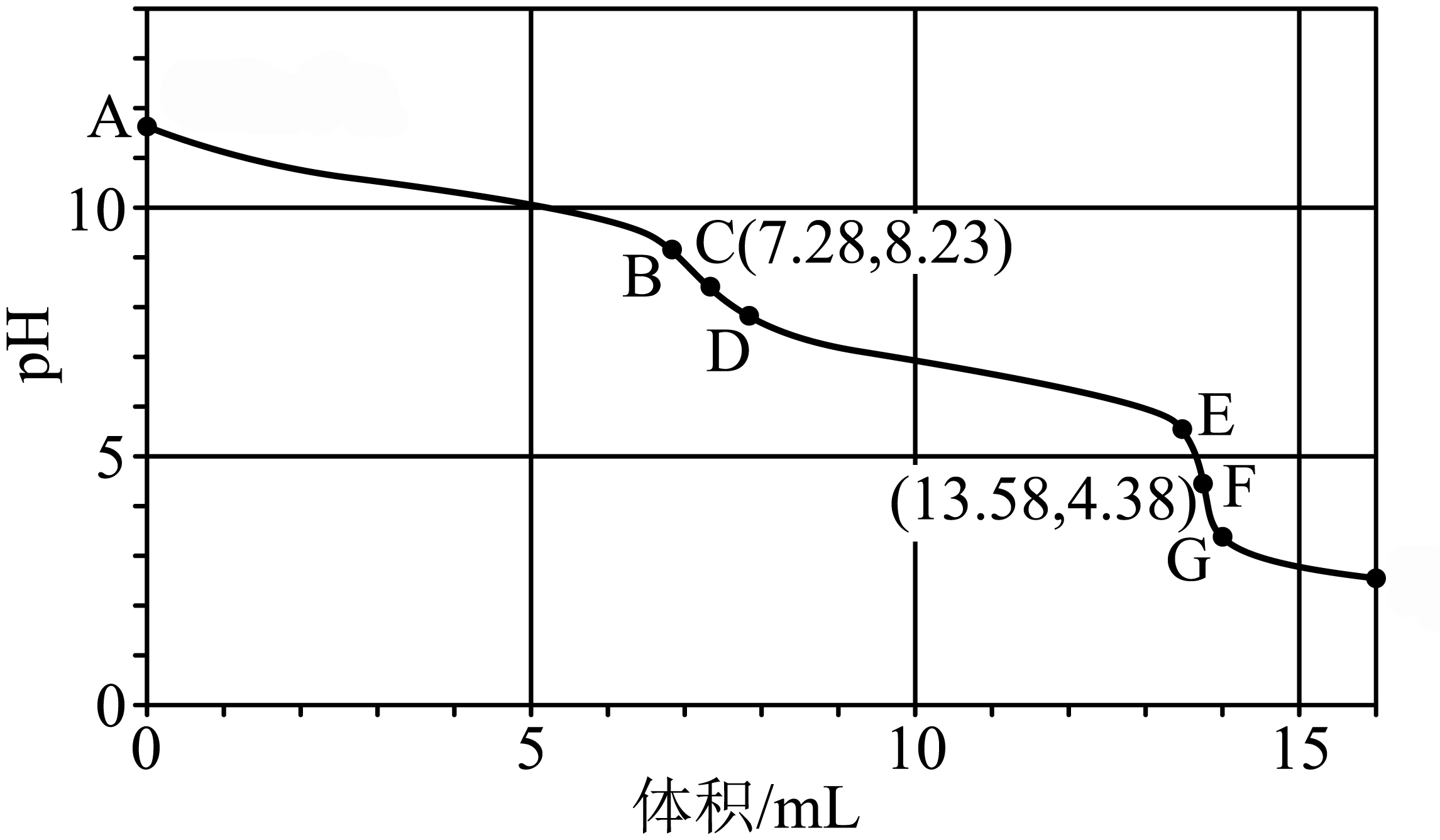
$\\rm A$点溶液显碱性的原因:$\\mathrm{CO}_{3}^{2-}+2 \\mathrm{H}_{2} \\mathrm{O} \\rightleftharpoons \\mathrm{H}_{2} \\mathrm{CO}_{3}+2 \\mathrm{OH}^{-}$
","$\\rm C$点溶液液中存在:$c\\left( \\text{C}{{\\text{l}}^{-}} \\right)\\gt c\\left( \\text{HCO}_{3}^{-} \\right)\\gt c\\left( \\text{O}{{\\text{H}}^{-}} \\right)\\gt c\\left( \\text{CO}_{3}^{2-} \\right)$
","确定$\\text{F}$点为滴定终点可选用酚酞作指示剂
","盐酸的物质的量浓度为$0.5523\\ \\text{mol}\\cdot {{\\text{L}}^{-1}}$
"]用某未知浓度的盐酸滴定$15.00\ \text{mL }0.5000\ \text{mol}\cdot {{\text{L}}^{-1}}\text{ N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液,首先碳酸根离子和氢离子生成碳酸氢根离子、碳酸氢根离子和氢离子生成碳酸,碳酸分解为二氧化碳和水;
$\rm A$.$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液显碱性,是因为$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液中$\text{CO}_{3}^{2-}$水解,其水解方程式为$\text{CO}_{3}^{2-}+{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{HCO}_{3}^{-}+\text{O}{{\text{H}}^{-}}$,$\rm A$项错误;
$\rm B$.$\text{C}$点第一突变点,溶质为等物质的量的碳酸氢钠与氯化钠溶液,且$\text{NaHC}{{\text{O}}_{3}}$的水解程度大于其电离程度,即溶液中离子浓度大小关系为$c{(\rm Na^+)}\gt c\left( \text{C}{{\text{l}}^{-}} \right)\gt c\left( \text{HCO}_{3}^{-} \right)\gt c\left( \text{O}{{\text{H}}^{-}} \right)\gt c\left( \text{CO}_{3}^{2-} \right)\gt c\rm(H^+)$,$\rm B$项正确;
$\rm C$.$\text{F}$点为滴定终点,溶液显酸性,指示剂为甲基橙,$\rm C$项错误;
$\rm D$.结合$\text{F}$点分析得:$ {c}\left( \text{HCl} \right)=\dfrac{ {2c}\left( \text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}} \right)\times {V}\left( \text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}} \right)}{ {V}\left( \text{HCl} \right)}=\dfrac{2\times 0.5000 \text{ mol}\cdot {{\text{L}}^{-1}}\times 15.00 \text{ mL}}{13.58\,\text{mL}}=1.104\,6\,\text{mol}\cdot {{\text{L}}^{-1}}$,则未知浓度的盐酸的物质的量浓度为$1.1046\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,$\rm D$项错误。
故选:$\rm B$
高中 | 盐溶液中粒子浓度大小比较题目答案及解析(完整版)
