高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
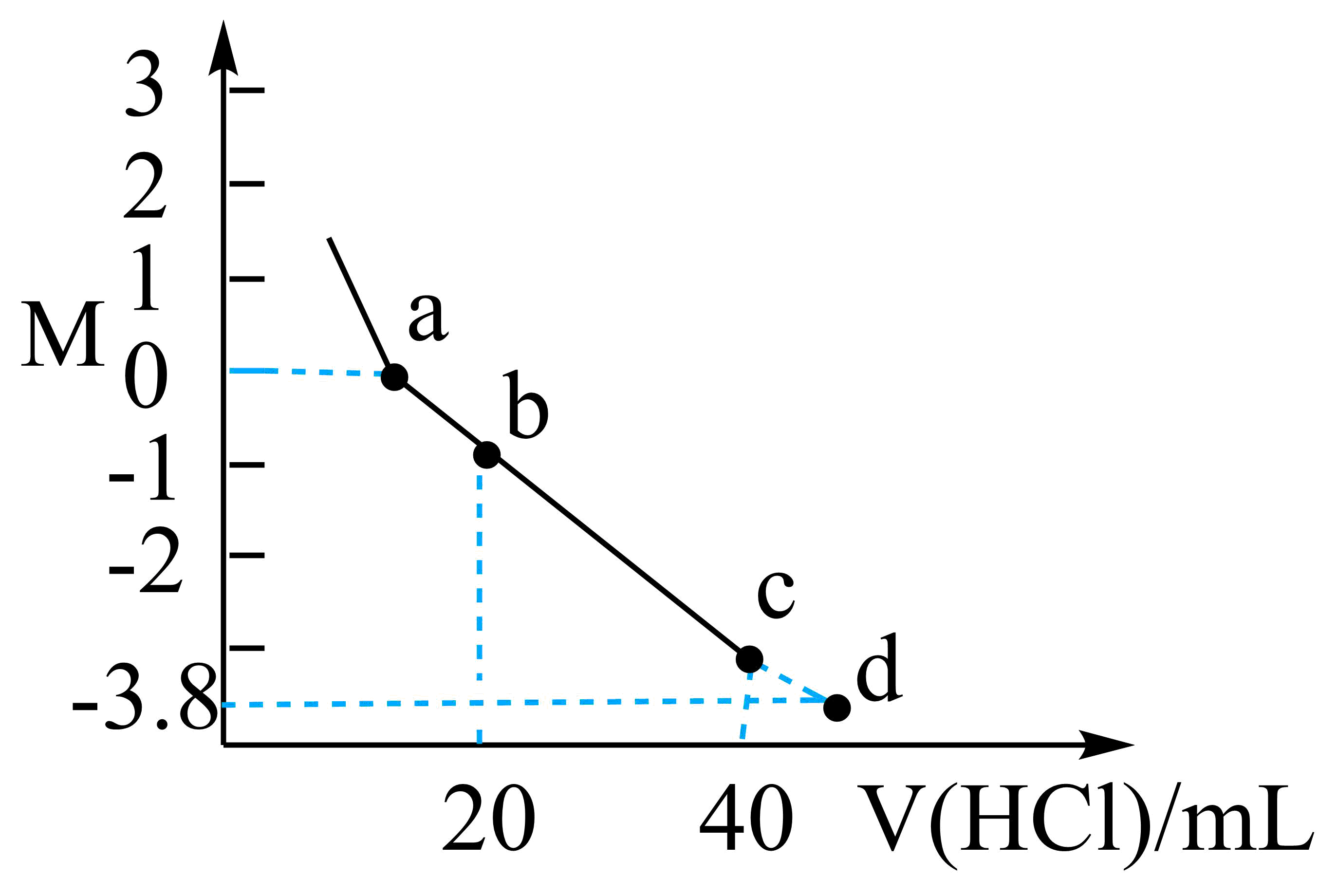
常温下,向$\text{20\;\rm mL 0} {.2\;\rm mol}\cdot {{\text{L}}^{\text{-1}}}$一元弱碱$\text{ROH}$溶液中逐滴加入$\text{0} {.1\;\rm mol}\cdot {{\text{L}}^{\text{-1}}}$盐酸,溶液的$ M$值$ [ {M=\lg}\dfrac{ {c\rm (ROH)}}{ {c}\left( {{\text{R}}^{+}} \right)}\rm ]$随加入盐酸体积的变化曲线如图所示。已知$\rm a$点$\text{pH=9}\text{.8}$,则下列说法中错误的是$(\qquad)$
${{K}_{\\text{b}}}\\text{(ROH)=1}\\times \\text{1}{{\\text{0}}^{\\text{-4}\\text{.2}}}$
","$\\rm b$点时,${c}\\left( {{\\text{R}}^{+}} \\right)\\gt {c}\\left( \\text{C}{{\\text{l}}^{-}} \\right)\\gt c\\text{(ROH)}\\gt c\\left( \\text{O}{{\\text{H}}^{-}} \\right)\\gt {c}\\left( {{\\text{H}}^{+}} \\right)$
","$\\rm c$点时,${c}\\left( \\text{C}{{\\text{l}}^{-}} \\right){=c}\\left( {{\\text{R}}^{+}} \\right) {+c\\rm(ROH)}$
","$\\rm a$、$\\rm b$、$\\rm c$、$\\rm d$四点中,水的电离程度最小的是$\\rm d$点
"]向$\rm 20\;\rm mL$ $\rm 0.2\;\rm mol\cdot L^{-1}$一元弱碱$\rm ROH$溶液中逐滴加入$\rm 0.1\;\rm mol\cdot L^{-1}$盐酸,发生反应$\rm ROH+HCl=RCl+H_{2}O$,由图可知,$\rm a$点$ M=\lg\dfrac{{c}\left( \text{ROH} \right)}{c\text{(}{{\text{R}}^{+}}\text{)}}\rm =0$,故${ c\rm(R^{+})}=c\rm(ROH)$,$\rm b$点加入盐酸体积为$\rm 20\;\rm mL$,溶质为等浓度的$\rm ROH$和$\rm RCl$,$\rm c$点加入盐酸体积为$\rm 40\;\rm mL$,溶质为$\rm RCl$,$\rm d$点加入盐酸大于$\rm 40\;\rm mL$,溶质为$\rm RCl$和$\rm HCl$。
$\rm A$. $\rm a$点$\rm pH=9.8$,$c\rm (H^{+})=10^{-9.8}\;\rm mol/L$,$c\rm (OH^{-})=10^{-4.2}\;\rm mol/L$,$\rm a$点$ M=\lg\dfrac{{c}\left( \text{ROH} \right)}{c\text{(}{{\text{R}}^{+}}\text{)}}\rm =0$,故${ c\rm (R^{+})}=c\rm (ROH)$,${K\rm _{b}(ROH)}=\dfrac{c\text{(}{{\text{R}}^{+}}\text{)}\cdot c\text{(O}{{\text{H}}^{-}}\text{)}}{{c}\left( \text{ROH} \right)} =c\rm (OH^{-})=1\times 10^{-4.2}$,故$\rm A$正确;
$\rm B$. $\rm b$点加入盐酸体积为$\rm 20\;\rm mL$,溶质为等浓度的$\rm ROH$和$\rm RCl$,$ M=\lg\dfrac{{c}\left( \text{ROH} \right)}{c\text{(}{{\text{R}}^{+}}\text{)}}\rm \lt 0$,故${ c\rm (R^{+})}\gt c\rm (ROH)$,说明溶液中$\rm ROH$电离程度大于$\rm R^{+}$水解程度,溶液显碱性,故${c}\left( {{\text{R}}^{+}} \right)\gt {c}\left( \text{C}{{\text{l}}^{-}} \right)\gt c\text{(ROH)}\gt c\left( \text{O}{{\text{H}}^{-}} \right)\gt {c}\left( {{\text{H}}^{+}} \right)$,故$\rm B$正确;
$\rm C$. $\rm c$点加入盐酸体积为$\rm 40\;\rm mL$,溶质为$\rm RCl$,由物料守恒可知${ c\rm (Cl^{-})}=c{\rm (R^{+})}+c\rm (ROH)$,故$\rm C$正确;
$\rm D$. $\rm a$点$\rm pH=9.8$,$c\rm (H^{+})=10^{-9.8}\;\rm mol/L$,$c\rm (OH^{-})=10^{-4.2}\;\rm mol/L$,溶液呈碱性,$c\rm (H^{+})_{水}=10^{-9.8}\;\rm mol/L$,$\rm d$点溶质为$\rm RCl$和$\rm HCl$,溶液显酸性,$ M=\lg\dfrac{{c}\left( \text{ROH} \right)}{c\text{(}{{\text{R}}^{+}}\text{)}}\rm =-3.8$,故$ { 10^{-3.8}c\rm (R^{+})}=c\rm (ROH)$,${K\rm _{b}(ROH)}=\dfrac{c\text{(}{{\text{R}}^{+}}\text{)}\cdot c\text{(O}{{\text{H}}^{-}}\text{)}}{{c}\left( \text{ROH} \right)} =10^{3.8}\times c\rm (OH^{-})=1\times 10^{-4.2}$,${ c\rm(OH^{-})}_{水}=10^{-8}\;\rm mol/L$,水的电离程度$\rm a\lt d$,$\rm b$点$\rm ROH$浓度减小,水的电离程度变大,$\rm c$点$\rm RCl$水解,促进水的电离,故水的电离程度最小的是$\rm a$点,故$\rm D$错误。
故选:$\rm D$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
