高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
石灰石是生产石灰、硅酸盐水泥的重要原料。其主要成分是碳酸钙,分解反应如下:
$\text{CaC}{{\text{O}}_{3}}\left( \text{s} \right)\rightleftharpoons \text{CaO}\left( \text{s} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta { H}={+178\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}}\qquad\Delta { S}=+160\text{ J}\cdot \text{mo}{{\text{l}}^{-1}}\cdot {{\text{K}}^{-1}}$
回答下列问题:
在不同的热力学温度下,$\text{C}{{\text{O}}_{2}}$分压对碳酸钙分解反应吉布斯自由能的影响如下图所示。
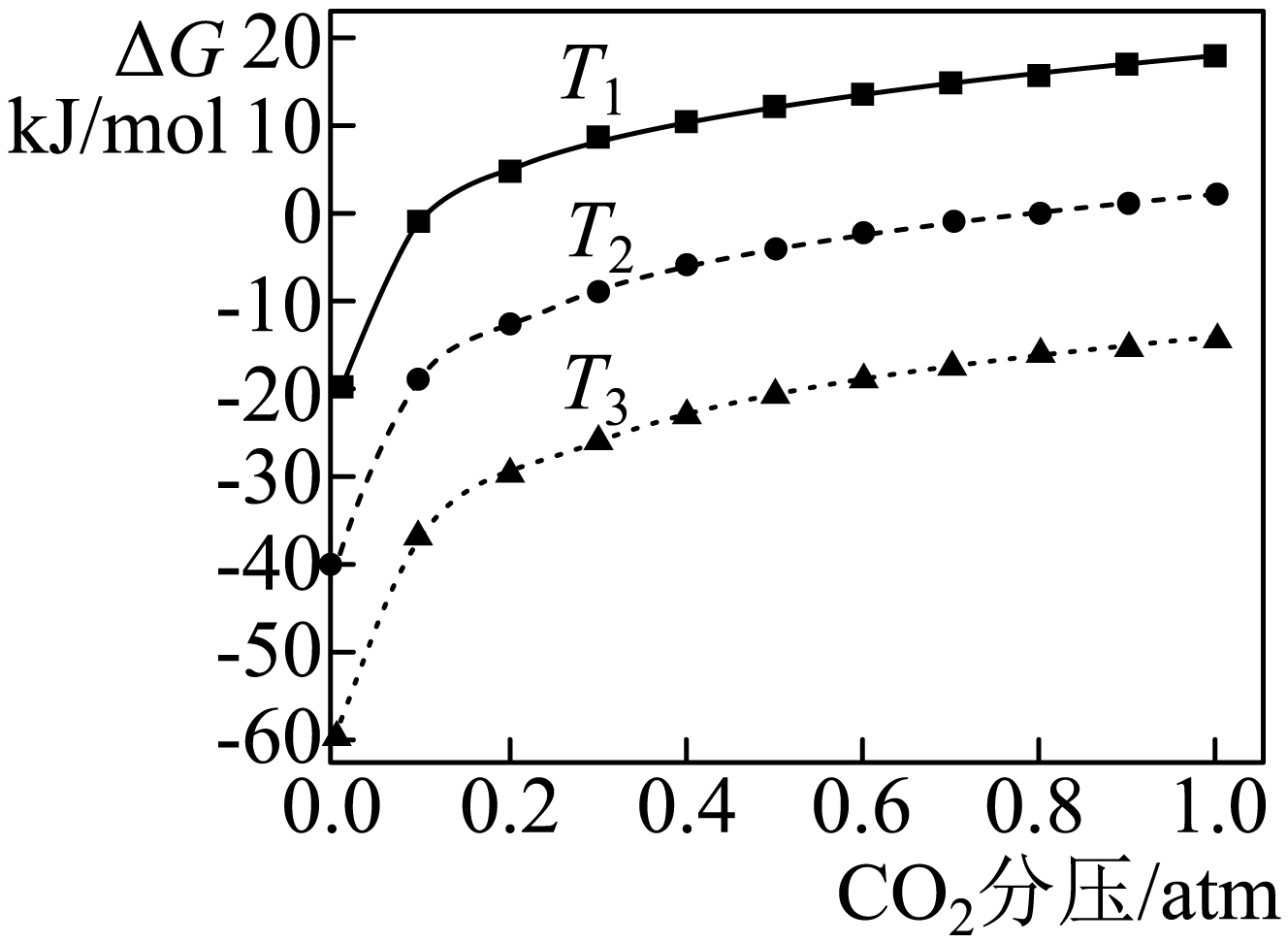
已知吉布斯自由能$\Delta { G}=\Delta { H}- {T } \Delta { S}\lt 0$时,正反应方向能自发进行,则碳酸钙分解反应的温度应大于 $\rm K$。$\text{C}{{\text{O}}_{2}}$分压越 $\rm ($填“高”或“低”$\rm )$碳酸钙越难分解;图中热力学温度由大到小的顺序为 ,理由是 $\rm ($从$\Delta{ G}$角度解释$\rm )$。
$\\rm 1112.5$;高;${{{T}}_{3}}\\gt {{{T}}_{2}}\\gt {{{T}}_{1}}$;$\\rm {C}{{{O}}_{2}}$分压相同时,根据$\\Delta{ G}=\\Delta{ H}-{T }\\Delta{ S}\\lt 0$,温度越高,$\\Delta{ G}$越小,越容易自发进行,故${{{T}}_{3}}\\gt {{{T}}_{2}}\\gt {{{T}}_{1}}$
"]]根据$\Delta {G=}\Delta {H-T}\Delta {S}$,令$\Delta{ G=0}$,可得${T=}\dfrac{\Delta{ H}}{{ }\Delta{ S}}=\rm\dfrac{{178000\;\rm J}\cdot {mo}{{{l}}^{{-1}}}}{{160\;\rm J}\cdot {mo}{{{l}}^{{-1}}}\cdot {{{K}}^{{-1}}}}{=1112}{.5\;K}$,即碳酸钙分解反应温度应大于$\rm 1112.5\;K$;相同温度下,$\rm {C}{{{O}}_{{2}}}$分压越高,${ }\Delta{ G}$越大,越难自发分解,所以$\rm {C}{{{O}}_{{2}}}$分压高时碳酸钙越难分解;由$\Delta {G=}\Delta {H-T}\Delta {S}$,$\Delta H\gt 0$,${ }\Delta{ S\gt 0}$,相同$\rm {C}{{{O}}_{{2}}}$分压下,${ }\Delta{ G}$越小,$ T$越大,图中相同$\rm {C}{{{O}}_{{2}}}$分压时,${ }\Delta{ G}$大小为${{{T}}_{{1}}}$曲线$ \gt {{{T}}_{{2}}}$曲线$ \gt {{{T}}_{3}}$曲线,所以热力学温度由大到小顺序为${{{T}}_{3}}\gt {{{T}}_{2}}\gt {{{T}}_{1}}$; $\rm {C}{{{O}}_{{2}}}$分压相同时,根据$\Delta G=\Delta H-T \Delta S\lt 0$,温度越高,$\Delta{ G}$越小,越容易自发进行,故${{{T}}_{3}}\gt {{{T}}_{2}}\gt {{{T}}_{1}}$。
某温度下将:$1\text{ mol CaC}{{\text{O}}_{3}}$固体装入容积为$\rm 1\;\rm L$的真空密闭容器内,充分发生反应:
反应Ⅰ:$\text{CaC}{{\text{O}}_{3}}\left( \text{s} \right)\rightleftharpoons \text{CaO}\left( \text{s} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\qquad{{ {K}}_ {\rm I}}=0.52\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$
反应Ⅱ:$2\text{C}{{\text{O}}_{\text{2}}}(\text{g})\rightleftharpoons 2\text{CO}(\text{g})+{{\text{O}}_{2}}(\text{g})\qquad {{ {K}}_\rm{II}}$
①该温度下达平衡后,$\text{CaC}{{\text{O}}_{3}}$有剩余,测得气体中${{\text{O}}_{2}}$的物质的量分数为$\rm 0.16$,则密闭容器内平衡时$\rm CaO$的物质的量为 $\rm mol$,反应Ⅱ平衡常数为 $\rm ($列出计算式$\rm )$。
②关于该平衡体系,下列说法正确的是 $\rm ($填标号$\rm )$。
$\rm A$.气体中$\dfrac{ {m}\left( \text{C} \right)}{{m}\left( \text{O} \right)}$恒定,则体系处于平衡状态
$\rm B$.压缩容器体积,达新平衡后$\rm \text{C}{{\text{O}}_{2}}$浓度不变
$\rm C$.通入$\rm \text{C}{{\text{O}}_{2}}$,再次达平衡,总压强增大
$\rm D$.混合气体的平均相对分子质量不再改变,体系处于平衡状态
$\\rm 0.84$;$\\dfrac{0.16\\times {{0.32}^{2}}}{{{0.52}^{2}}}$;$\\rm BD$
"]]①设反应$\rm I$生成$x\;\rm mol\;\rm CaO$(即生成$x\;\rm mol\text{ C}{{\text{O}}_{\text{2}}}$),反应$\rm II$生成$y\;\rm mol{{\text{ O}}_{\text{2}}}$(则生成$ 2y\rm\;mol\;\rm CO$,消耗$ 2y\rm\;mol\;\text{C}{{\text{O}}_{\text{2}}}$),平衡时$\text{C}{{\text{O}}_{\text{2}}}$为$x- 2y$,由${{ {K}}_{\text{I}}} {=c\rm(C}{{\text{O}}_{\text{2}}} {)=0} {.52\;\rm mol}\cdot {{\text{L}}^{\text{-1}}}$(体积$\rm 1\;\rm L$),
且$\dfrac{{y}}{{(x-2y)+2y+y}}{=0}{.16}$,即$\dfrac{{y}}{{x+y}}{=0}{.16}$,又$x-2y= 0.52$,联立解得$x= 0.84$,$y= 0.16$;反应$\rm II$平衡常数${{{K}}_{\rm {II}}}=\dfrac{{{{c}}^{{2}}}{\rm (CO)}\cdot {c(}{{\rm {O}}_{{2}}}{)}}{{{{c}}^{{2}}}{\rm (C}{{\rm {O}}_{{2}}}{)}}=\dfrac{{0}{.3}{{{2}}^{{2}}}\times {0}{.16}}{{0}{.5}{{{2}}^{{2}}}}$(${c}\left(\rm {CO} \right){=0}{.32\;\rm mol/L}$、${c}\left(\rm {{{O}}_{{2}}} \right){=0}{.16\;\rm mol/L}$、${c}\left(\rm {C}{{{O}}_{{2}}} \right){=0}{.52\;\rm mol/L}$),
故平衡时$\rm CaO$的物质的量为$\rm 0.84\;\rm mol$,反应$\rm II$平衡常数为$\dfrac{{0}{.3}{{{2}}^{{2}}}\times {0}{.16}}{{0}{.5}{{{2}}^{{2}}}}$;
②$\rm A$.反应中$\rm C$、$\rm O$原子个数比固定,$\dfrac{{m\rm (C)}}{{m\rm (O)}}$恒定不能判断平衡,$\rm A$错误;
$\rm B$.温度不变,${{{K}}_{\rm {I}}}{=c}\left(\rm {C}{{{O}}_{{2}}} \right)$不变,压缩容器体积,$\rm {C}{{{O}}_{{2}}}$浓度不变,$\rm B$正确;
$\rm C$.温度不变,${{{K}}_{\rm {I}}}$不变,$\rm {C}{{{O}}_{{2}}}$浓度不变,总压强不变,$\rm C$错误;
$\rm D$.混合气体平均相对分子质量不再改变,说明气体总物质的量不变,反应达平衡,$\rm D$正确;
过量碳酸钙粉末置于水中达到沉淀溶解平衡,上层清液中有关离子浓度大小关系正确的是$(\quad\ \ \ \ )\rm ($填标号$\rm )$。$\rm [$已知${{ {K}}_{\text{sp}}}\left( \text{CaC}{{\text{O}}_{3}} \right)=3.4\times {{10}^{-9}}$,${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$的电离常数${{ {K}}_{{{\text{a}}_{1}}}}=4.5\times {{10}^{-7}}$,${{ {K}}_{{{\text{a}}_{2}}}}=4.7\times {{10}^{-11}}\rm ]$
${c}\\left( \\text{C}{{\\text{a}}^{2+}} \\right)={c}\\left( \\text{CO}_{3}^{2-} \\right)$
","${c}\\left( \\text{C}{{\\text{a}}^{2+}} \\right)\\gt {c}\\left( \\text{CO}_{3}^{2-} \\right)$
","${c}\\left( \\text{HCO}_{3}^{-} \\right)\\gt {c}\\left( \\text{CO}_{3}^{2-} \\right)$
","${c}\\left( \\text{CO}_{3}^{2-} \\right)\\gt {c}\\left( \\text{HCO}_{3}^{-} \\right)$
"]对于过量碳酸钙粉末置于水中的沉淀溶解平衡体系:
由$\text{CaC}{{\text{O}}_{\text{3}}}\text{(s)}\rightleftharpoons \text{C}{{\text{a}}^{\text{2+}}}\text{(aq)+CO}_{\text{3}}^{\text{2-}}\text{(aq)}$,$\text{CO}_{\text{3}}^{\text{2-}}$会发生水解,导致$ {c\rm (C}{{\text{a}}^{\text{2+}}} {)\gt c\rm (CO}_{\text{3}}^{\text{2-}}\text{)}$,故$\rm A$错误,$\rm B$正确;$\text{CO}_{\text{3}}^{\text{2-}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{HCO}_{\text{3}}^{-}\text{+O}{{\text{H}}^{-}}$,其水解常数${{{K}}_{\text{h}}}\text{(CO}_{\text{3}}^{\text{2-}} {)=}\dfrac{{{{K}}_{\text{w}}}}{{{{K}}_{\text{a2}}}}=\dfrac{\text{1}\times \text{1}{{\text{0}}^{ {-14}}}}{\text{4}\text{.7}\times \text{1}{{\text{0}}^{\text{-11}}}}\approx \text{2}\text{.13}\times \text{1}{{\text{0}}^{\text{-4}}}$,由于${{{K}}_{\text{h}}}\text{(CO}_{\text{3}}^{\text{2-}}\text{)}\gt {{{K}}_{\text{a2}}}$,所以$ {c\rm (HCO}_{\text{3}}^{-} {)\gt c\rm (CO}_{\text{3}}^{\text{2-}}\text{)}$,$\text{CO}_{\text{3}}^{\text{2-}}$水解程度大于$\text{HCO}_{\text{3}}^{-}$电离程度,故$\rm C$正确,$\rm D$错误。
高中 | 化学平衡常数题目答案及解析(完整版)
