高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
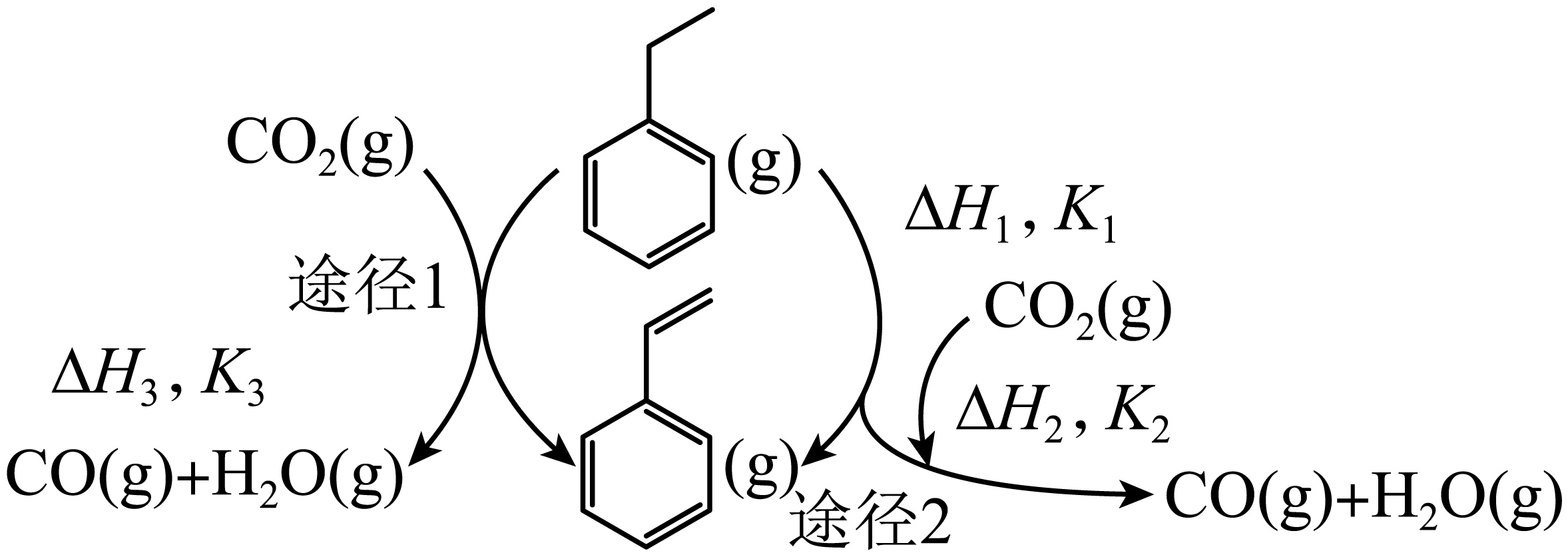
苯乙烯是重要的有机合成单体,常用乙苯为原料合成,以$\rm CO_{2}$和乙苯为原料合成苯乙烯,其过程如下图,有“一步”途径$\rm 1$和“二步”途径$\rm 2$的两种推测。
$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+$![]() $\rm (g)\overset{催化剂}{\mathop{\rightleftharpoons }}\,$
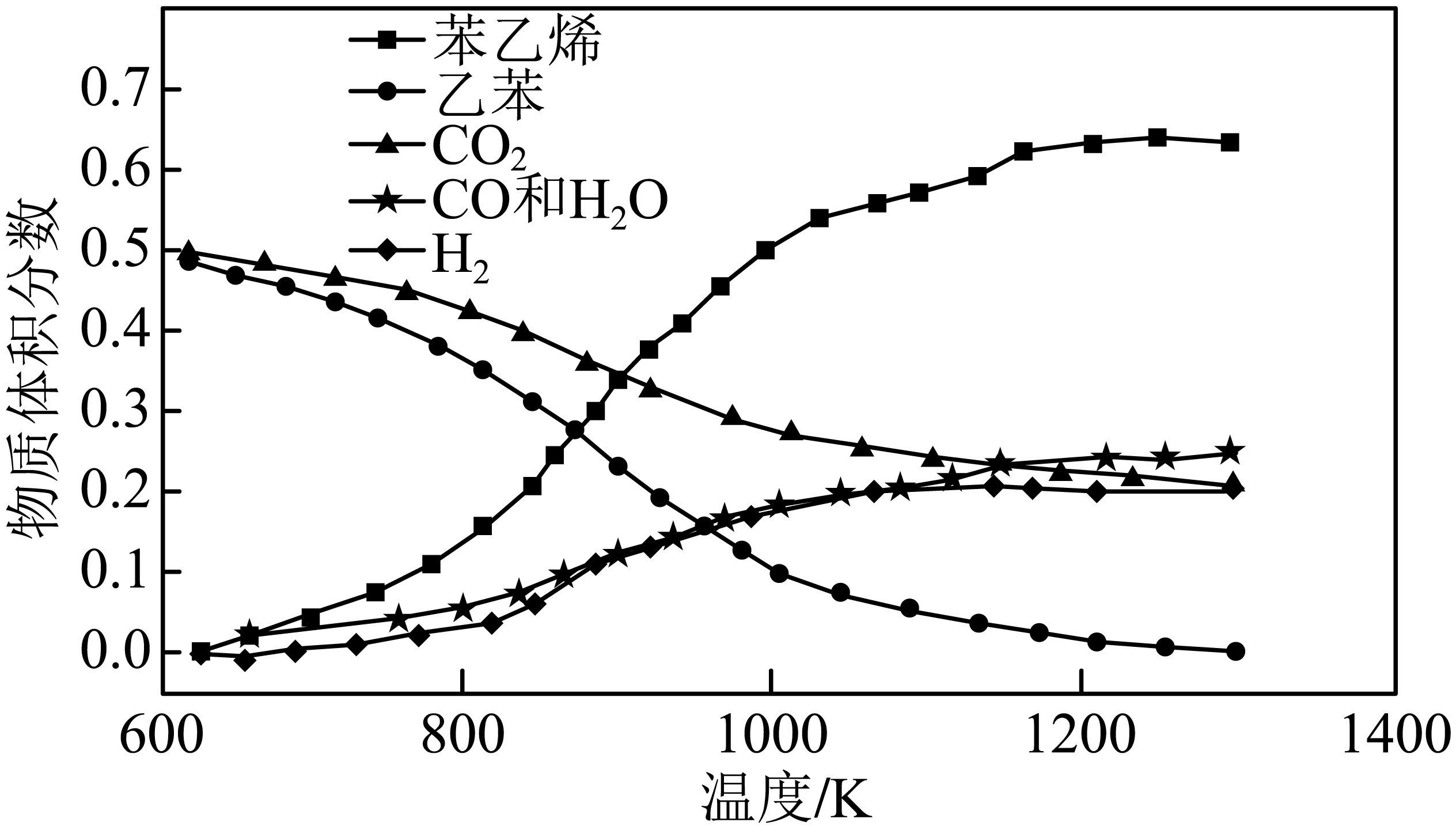
$\rm (g)\overset{催化剂}{\mathop{\rightleftharpoons }}\,$![]() $\rm (g)\text{+CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$平衡常数$K_{3}=$ $($用含$K_{1}$、$K_{2}$的代数式表达$)$。向刚性容器中充入等物质的量$\rm CO_{2}$和乙苯,发生途径$\rm 1$反应,不同温度下测得平衡时各物质的体积分数如下图,可推知随温度升高${{ {K}}_{\text{3}}}$ $\rm ($填“增大”或“减小”$\rm )$,相同温度下$\rm CO_{2}$转化率低于乙苯,推知发生了副反应$\text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)$,由图象知该反应的$ \Delta H$ $\rm 0$。
$\rm (g)\text{+CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$平衡常数$K_{3}=$ $($用含$K_{1}$、$K_{2}$的代数式表达$)$。向刚性容器中充入等物质的量$\rm CO_{2}$和乙苯,发生途径$\rm 1$反应,不同温度下测得平衡时各物质的体积分数如下图,可推知随温度升高${{ {K}}_{\text{3}}}$ $\rm ($填“增大”或“减小”$\rm )$,相同温度下$\rm CO_{2}$转化率低于乙苯,推知发生了副反应$\text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)$,由图象知该反应的$ \Delta H$ $\rm 0$。
$ K_{1}K_{2}$;增大;$\\rm \\gt $
"]]根据图$\rm 1$所示信息可知,途径$\rm 2$反应分别为:$\rm I$.![]() $\rm (g)$ $\rightleftharpoons $
$\rm (g)$ $\rightleftharpoons $![]() ${\rm (g)+H_{2}(g)}\qquad K_{1}$;
${\rm (g)+H_{2}(g)}\qquad K_{1}$;
$\rm I I$.${\rm CO_{2}(g)+H_{2}(g)\rightleftharpoons \rm CO(g)+H_{2}O(g)}\qquad K_{2}$,
途径$\rm 1$反应为:$\rm II I$.$\rm CO_{2}(g)+$![]() $\rm (g) \overset{催化剂 }{\underset{ }{\rightleftharpoons}}$
$\rm (g) \overset{催化剂 }{\underset{ }{\rightleftharpoons}}$![]() ${\rm (g)+CO(g)+H_{2}O(g)}\qquad K_{3}$,则有$\rm III=I+II$,故$ K_{3}= K_{1}K_{2}$;
${\rm (g)+CO(g)+H_{2}O(g)}\qquad K_{3}$,则有$\rm III=I+II$,故$ K_{3}= K_{1}K_{2}$;
由图$\rm 2$所示信息可知,温度越高苯乙烯的体积分数越大,说明反应的化学平衡正向移动,故正反应为吸热反应$\Delta H_{3}\gt 0$;则升温平衡常数$ K_{3}$增大;相同温度下$\rm CO_{2}$转化率低于乙苯,说明副反应生成的$\rm CO_{2}$随温度升高也越来越多,即升高温度副反应$\rm CO(g)+H_{2}O(g)\rightleftharpoons \rm CO_{2}(g)+H_{2}(g)$化学平衡正向移动,由图象知该反应$\Delta H\gt 0$;
某团队研究途径$\rm 2$,找到无需$\rm CO_{2}$的乙苯直接脱氢的高效催化剂,原理如图:![]() $\left( \text{g} \right)\overset{催化剂}{\mathop{\rightleftharpoons }} {{\text{H}}_{\text{2}}}\left( \text{g} \right)+$
$\left( \text{g} \right)\overset{催化剂}{\mathop{\rightleftharpoons }} {{\text{H}}_{\text{2}}}\left( \text{g} \right)+$![]() $\left( \text{g} \right)\qquad\Delta { H}$。工业上,通常在乙苯$\rm (EB)$蒸气中掺混$\rm N_{2}($原料气中乙苯和$\rm N_{2}$的物质的量之比为$\rm 1: 10$;$\rm N_{2}$不参与反应$\rm )$,控制反应温度$\rm 600\;\rm ^\circ\rm C$,并保持体系总压为$\rm 0.1\;MPa$不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性$\rm ($指除了$\rm H_{2}$以外的产物中苯乙烯的物质的量分数$\rm )$示意图如下。
$\left( \text{g} \right)\qquad\Delta { H}$。工业上,通常在乙苯$\rm (EB)$蒸气中掺混$\rm N_{2}($原料气中乙苯和$\rm N_{2}$的物质的量之比为$\rm 1: 10$;$\rm N_{2}$不参与反应$\rm )$,控制反应温度$\rm 600\;\rm ^\circ\rm C$,并保持体系总压为$\rm 0.1\;MPa$不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性$\rm ($指除了$\rm H_{2}$以外的产物中苯乙烯的物质的量分数$\rm )$示意图如下。
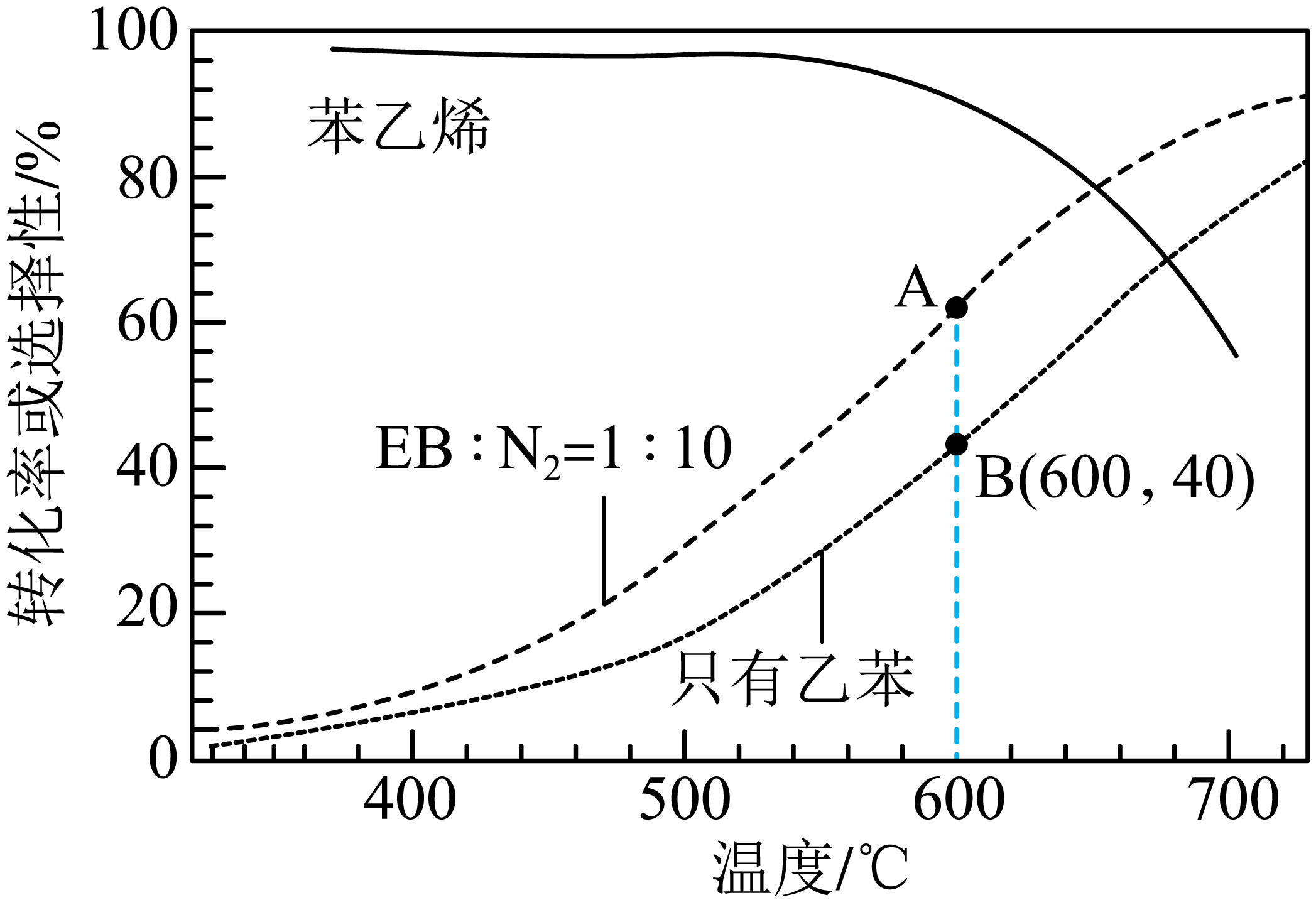
①掺入$\rm N_{2}$能提高乙苯的平衡转化率,解释说明该事实 。
②$\rm AB$两点对应的正反应速率较小的是 。
③用平衡分压代替平衡浓度计算$\rm 600\;\rm ^\circ\rm C$时的平衡常数$ K\rm_{p}=$ $\rm MPa$。
④控制反应温度为$\rm 600\;\rm ^\circ\rm C$的理由是 。
正反应方向气体分子数增加,加入氮气稀释,相当于起减压的效果,平衡正向移动,乙苯的转化率提高;$\\rm A$;$\\rm 0.019$;$\\rm 600\\;\\rm ^\\circ\\rm C$时,乙苯的转化率和苯乙烯的选择性均较高,温度过低,反应速率慢,转化率低;温度过高,选择性下降,高温还可能使催化剂失活,且能耗大
"]]①该反应正反应气体分子数增加,恒压条件下加入氮气,相当于减压,减小压强,化学平衡正向移动,乙苯的转化率增大;
②由题图可知,$\rm A$、$\rm B$两点对应的温度和压强都相同,$\rm A$点是乙苯和氮气的混合气体,$\rm B$点是纯乙苯,则$\rm B$点乙苯浓度大于$\rm A$ 点,浓度越大反应速率越大,则正反应速率$\rm B$点大于$\rm A$点,故正反应速率较小的是$\rm A$;
③由题图可知,反应温度为$\rm 600\;\rm ^\circ\rm C$,并保持体系总压为$\rm 0.1\;MPa$时,乙苯转化率为$\rm 40\%$,设乙苯起始物质的量为$\rm 1\;\rm mol$,则依据题意可建立如下三段式:$\begin{matrix} {} &乙苯 \left( \text{g} \right) & \rightleftharpoons & {{\text{H}}_{\text{2}}}\left( \text{g} \right) \\起始量 \text{(mol)} & 1 & {} & \text{0} \\ 转化量\text{(mol)} & \text{0}\text{.4} & {} & 0.4 \\平衡量 \text{(mol)} & 0.6 & {} & 0.4 \\ \end{matrix}\begin{matrix} +苯乙烯\text{(g)} \\ \text{0} \\ 0.4 \\ 0.4 \\ \end{matrix}$,平衡时总物质的量为$\rm 1.4\;\rm mol$,乙苯的平衡分压为$\dfrac{0.6}{1.4}\times \rm 0.1\;MPa$,苯乙烯和氢气的平衡分压均为$\dfrac{0.4}{1.4}\times \rm 0.1\;MPa$,则$\rm 600\;\rm ^\circ\rm C$时的平衡常数${{K}_{\text{p}}}=\dfrac{{{(\dfrac{0.4}{1.4}\times 0.1\text{ MPa})}^{2}}}{\dfrac{0.6}{1.4}\times 0.1\text{ MPa}}\approx 0.019\;\rm MPa$;
④根据题图可知,$\rm 600\; ^\circ\rm C$时,乙苯的转化率和苯乙烯的选择性均较高,该反应为吸热反应,若温度过低,化学反应速率慢,乙苯的转化率低;若温度过高,苯乙烯的选择性下降,高温还可能使催化剂失活,且能耗大;
实验测得,乙苯脱氢的速率方程为${{ {v}}_正{}}={{{k}}_正{}}{{{p}}_ {乙苯}}$,${{ {v}}_逆{}}={{{k}}_逆{}}{{ {p}}_ {苯乙烯}}{{ {p}}_ {氢气}} ({{{k}}_正{}}$、${{{k}}_逆{}}$为速率常数,只与温度有关$\rm )$,下图中④代表$\lg{{{k}}_正{}}$随$ 1/T$的变化关系,则能代表$\lg{{{k}}_逆{}}$随$ 1/T$的变化关系的是 $\rm ($填序号$\rm )$。
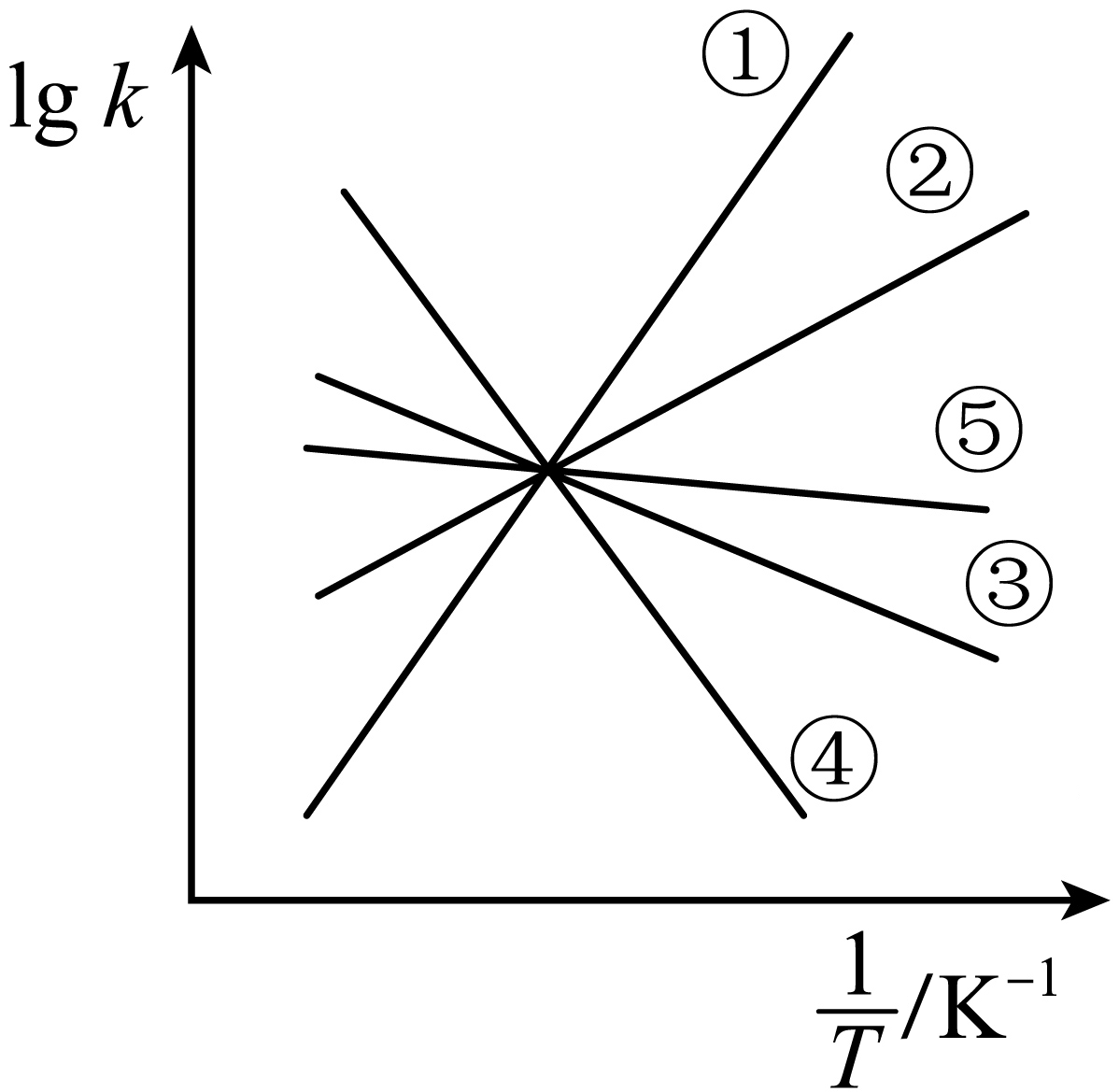
③或⑤
"]]实验测得,乙苯脱氢的速率方程为${{ {v}}_正{}}={{{k}}_正{}}{{{p}}_ {乙苯}}$,${{ {v}}_逆{}}={{{k}}_逆{}}{{ {p}}_ {苯乙烯}}{{ {p}}_ {氢气}} ({{{k}}_正{}}$、${{{k}}_逆{}}$为速率常数,只与温度有关$\rm )$,达到平衡时,${v} _{正}={v}\rm _{逆}$,即$ k_{正}p_{乙苯}=k_{逆}p_{苯乙烯}p_{氢气}$,则有$\dfrac{{{{k}}_正{}}}{{{{k}}_逆{}}}=\dfrac{{{{p}}_ {苯乙烯}}{{{p}}_ {氢气}}}{{{{p}}_ {乙苯}}} =K $,由上一问可知乙苯脱氢反应正反应是一个吸热反应,故温度越高平衡正向移动,正反应速率加快的倍数大于逆反应速率增大的倍数,即$\dfrac{{{{k}}_正{}}}{{{{k}}_逆{}}}$随温度升高而增大,且${{{k}}_正{}}$增大的倍数大于${{{k}}_逆{}}$增大的倍数,图像从右向左是升温,若④代表$\lg{{{k}}_正{}}$随$\dfrac{1}{{T}}$的变化关系,则③或⑤代表$\lg k_{逆}$随$\dfrac{1}{{T}}$的变化关系。
高中 | 化学平衡常数题目答案及解析(完整版)
