高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
含氮化合物具有广泛应用,回答下列问题。
已知${{\text{H}}_{2}}、\text{N}{{\text{H}}_{3}}$的燃烧热($\Delta H$)分别为$\textit{a}\;\rm kJ\cdot \text{mo}{{\text{l}}^{-1}}$,$\textit{b}\rm\ kJ\cdot \text{mo}{{\text{l}}^{-1}}$,写出合成氨的热化学反应方程式 。
${{\\text{N}}_{2}}\\left( \\text{g} \\right)+3{{\\text{H}}_{2}}\\left( \\text{g} \\right)\\rightleftharpoons 2\\text{N}{{\\text{H}}_{3}}\\left( \\text{g} \\right)\\text{ }\\qquad\\Delta\\!\\!\\textit{ H}=\\left( 3\\textit{a}-2\\textit{b} \\right)\\;\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]燃烧热是在$\rm 101$ $\rm kPa$时,$\rm 1$ $\rm mol$纯物质完全燃烧生成指定产物时所放出的热量;已知${{\text{H}}_{2}}、\text{N}{{\text{H}}_{3}}$的燃烧热($\Delta \textit{H}$)分别为$a\;\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,$b\;\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,则:
①${{\text{H}}_{\text{2}}}\left( \text{g} \right)+\dfrac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\qquad\Delta \textit{H}=a\;\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
②$\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+\dfrac{3}{\text{4}}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\dfrac{\text{1}}{\text{2}}{{\text{N}}_{2}}\left( \text{g} \right)+\dfrac{3}{\text{2}}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\qquad\Delta \textit{H}=b\;\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
由盖斯定律,$\rm 3\times $①$\rm -2\times $②得${{\text{N}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{H}}_{3}}\left( \text{g} \right)\qquad\Delta\!\!\textit{ H}=\left( 3\textit{a}-2\textit{b} \right)\;\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
在$\rm 500\;K$,体积为$\rm 1\;\rm L$的恒容容器中,对于合成氨反应,初始投料${{\text{N}}_{2}}\left( \text{g} \right)$为$\rm 0.2\;\rm mol$,${{\text{H}}_{2}}\left( \text{g} \right)$为$0.05\;\rm \text{mol}$,$\text{N}{{\text{H}}_{3}}\left( \text{g} \right)$为$\rm 0.15\;\rm mol$,以下可说明反应达到平衡的有 (填序号)。
①${{\text{H}}_{2}}$的体积分数不变 ②${{\text{N}}_{2}}$的物质的量分数不变 ③气体总压不变
④$\text{N}{{\text{H}}_{3}}$的分压不变 ⑤体系密度不变
①③④
"]]①${{\text{H}}_{2}}$的体积分数不变,则平衡不再移动,说明达到平衡;
②由题意:
$\begin{matrix} {} \\ 起始\left( \text{mol} \right) \\ 转化\left( \text{mol} \right) \\ 平衡\left( \text{mol} \right) \\ \end{matrix}\begin{matrix} {{\text{N}}_{\text{2}}}\text{(g)} \\ \text{0}\text{.2} \\ \textit{a} \\ \text{0.2}-\textit{a} \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{3}{{\text{H}}_{\text{2}}}\text{(g)} \\ \text{0}\text{.05} \\ 3\textit{a} \\ \text{0.05}-3\textit{a} \\ \end{matrix}\begin{matrix} \underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\, \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{2N}{{\text{H}}_{\text{3}}}\text{(g)} \\ \text{0}\text{.15} \\ 2\textit{a} \\ \text{0.15}-2\textit{a} \\ \end{matrix}$
反应后总的物质的为$ 0.4-2a$,则${{\text{N}}_{2}}$的物质的量分数$\dfrac{\text{0}.2-a}{\text{0}.4-2a}=0.5$,为定值,其不变,不能说明反应平衡;
③恒容容器中进行气体分子数减小的反应,气体总压不变,则平衡不再移动,说明达到平衡;
④$\text{N}{{\text{H}}_{3}}$的分压不变,则平衡不再移动,说明达到平衡;
⑤容器体积和气体总质量始终不变,则混合气体的密度始终不变,因此不能说明反应已达平衡;
故选:①③④
在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如图所示(物质$\rm i$的摩尔分数:${{\textit{x}}_{\text{i}}}=\dfrac{{{\textit{n}}_{\text{i}}}}{{{\textit{n}}_{总}}}$)。其中一种进料组成为$x_{\mathrm{H}_2}=0.75$,$x_{\mathrm{N}_2}=0.25$,另一种为$x_{\mathrm{H}_2}=0.675$、$x_{\mathrm{N}_2}=0.225$、${{\textit{x}}_{\text{Ar}}}=0.10$。
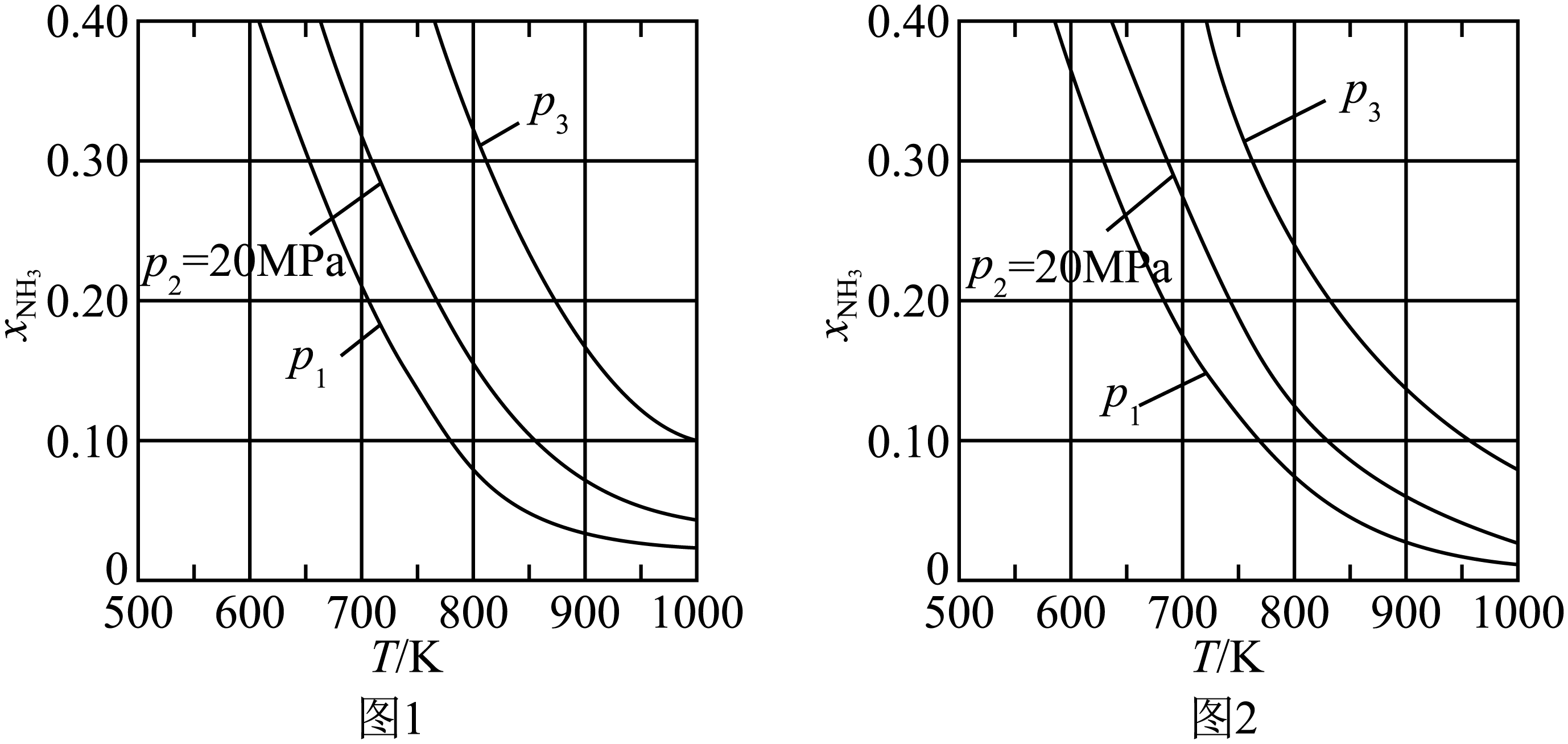
①图中压强由小到大的顺序为 ,判断的依据是 。
②进料组成中含有惰性气体$\rm Ar$的图是 。
③图$\rm 1$中,当$p_2=20\ \mathrm{MPa}$、${{\textit{x}}_{\text{N}{{\text{H}}_{3}}}}=0.20$时,氮气转化率$\alpha=$ (保留$\rm 3$位有效数字),该温度时,反应$\dfrac{1}{2}{{\text{N}}_{2}}\left( \text{g} \right)+\dfrac{3}{2}{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{N}{{\text{H}}_{3}}\left( \text{g} \right)$的平衡常数${{\textit{K}}_{\text{p}}}=$ ${{(\text{MPa})}^{-1}}$(化为最简式)。
${{\\textit{p}}_{1}}\\lt {{\\textit{p}}_{2}}\\lt {{\\textit{p}}_{3}}$ ;合成氨的反应为气体分子数减少的反应,压强越大平衡时氨的摩尔分数越大 ;图$\\rm 2$;$\\rm 33.3\\%$; $\\sqrt{\\dfrac{1}{432}}$(或$\\dfrac{\\sqrt{3}}{36}$)
"]]①合成氨的反应为气体分子数减小的反应,压强越大越有利于氨的合成,因此压强越大平衡时氨的摩尔分数越大,结合图中信息可知,在相同温度下,反应达平衡时氨的摩尔分数${{\textit{p}}_{1}}\lt {{\textit{p}}_{2}}\lt {{\textit{p}}_{3}}$,因此,图中压强由小到大的顺序为${{\textit{p}}_{1}}\lt {{\textit{p}}_{2}}\lt {{\textit{p}}_{3}}$;判断的依据是:合成氨的反应为气体分子数减少的反应,压强越大平衡时氨的摩尔分数越大。
②对比图$\rm 1$和图$\rm 2$中的信息可知,在相同温度和相同压强下,图$\rm 2$中平衡时氨的摩尔分数较小。在恒压下充入惰性气体,反应混合物中各组分的浓度减小,各组分的分压也减小,化学平衡要朝气体分子数增大的方向移动,因此,充入惰性气体不利于合成氨,进料组成中含有惰性气体的图是图$\rm 2$。
③图$\rm 1$中,进料组成为两者物质的量之比为$\rm 3:1$,假设进料中氢气和氮气的物质的量分别为$\rm 3\;\rm mol$和$\rm 1\;\rm mol$,达到平衡时氮气的变化量为$a\rm\ mol$,则有:
$\begin{matrix} {} \\ 起始\left( \text{mol} \right) \\ 转化\left( \text{mol} \right) \\ 平衡\left( \text{mol} \right) \\ \end{matrix}\begin{matrix} {{\text{N}}_{\text{2}}}\text{(g)} \\ \text{1} \\ \textit{a} \\ 1-a \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{3}{{\text{H}}_{\text{2}}}\text{(g)} \\ \text{3} \\ 3a \\ 3-3a \\ \end{matrix}\begin{matrix} \underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\, \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{2N}{{\text{H}}_{\text{3}}}\text{(g)} \\ \text{0} \\ 2a \\ 2a \\ \end{matrix}$
总的物质的量为$ 4-2a$,当$p_2=20\ \mathrm{MPa}$、${{\textit{x}}_{\text{N}{{\text{H}}_{3}}}}=0.20$时,则$\dfrac{2\textit{a}}{4-2\textit{a}}=0.20$,$\textit{a}=\dfrac{1}{3}$,氮气转化率$\alpha=\dfrac{3\times \dfrac{1}{3}}{3}\times \text{100 }\!\!\%=33.3\%$;平衡时氮气、氢气、氨气的物质的量分别为$\dfrac{2}{3}\rm\ mol$、$\rm 2\;\rm mol$、$\dfrac{2}{3}\rm\ mol$,其物质的量分数分别为$\dfrac{1}{5}$、$\dfrac{3}{5}$、$\dfrac{1}{5}$,则该温度下反应${{\text{N}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{H}}_{3}}\left( \text{g} \right)$的平衡常数${{\textit{K}}_{\text{p}}}=\dfrac{{{\left( \dfrac{1}{5}\times 20 \right)}^{2}}}{\left( \dfrac{1}{5}\times 20 \right)\times {{\left( \dfrac{3}{5}\times 20 \right)}^{\text{3}}}}\;{{(\text{MPa})}^{-2}}=\dfrac{16}{4\times {{12}^{\text{3}}}}\;{{(\text{MPa})}^{-2}}$,故反应$\dfrac{1}{2}{{\text{N}}_{2}}\left( \text{g} \right)+\dfrac{3}{2}{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{N}{{\text{H}}_{3}}\left( \text{g} \right)$的平衡常数${{\textit{K}}_{\text{p}}}=\sqrt{\dfrac{16}{4\times {{12}^{\text{3}}}}\;{{(\text{MPa})}^{-2}}}=\sqrt{\dfrac{1}{432}}\;{{(\text{MPa})}^{-1}}$(或$\dfrac{\sqrt{3}}{36}\;{{(\text{MPa})}^{-1}}$)。
高中 | 化学平衡常数题目答案及解析(完整版)
