高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
先进的甲醇低压羰基合成乙酸工艺的普及推广,导致我国乙酸产能过剩。使用特定催化剂进行乙酸直接加氢制备乙醇,反应原理如下:
主反应:${\rm CH_{3}COOH(g)+2H_{2}(g)⇌CH_{3}CH_{2}OH(g)+H_{2}O(g)}\qquad\Delta H_{1}$
副反应:${\rm CH_{3}COOH(g)+CH_{3}CH_{2}OH(g)⇌CH_{3}CH_{2}OOCCH_{3}(g)+H_{2}O(g)}\qquad\Delta H_{2}\lt 0$
回答下列问题:
一定温度下,将不同量的原料通入到恒压密闭容器中,副反应热效应小,可忽略。则该温度下主反应的$\Delta H_{1}=$ $\rm kJ/mol$。
| 实验编号 | 反应物投入量 | 平衡时,热量变化 | |||
| $\rm CH_{3}COOH(g)$ | $\rm H_{2}(g)$ | $\rm CH_{3}CH_{2}OH(g)$ | $\rm H_{2}O(g)$ | ||
| Ⅰ | $\rm 0.5\;\rm mol$ | $\rm 1\;\rm mol$ | $\rm 0$ | $\rm 0$ | 放热$x\;\rm kJ$ |
| Ⅱ | $\rm 0$ | $\rm 0$ | $\rm 1\;\rm mol$ | $\rm 1\;\rm mol$ | 吸热$y\;\rm kJ$ |
$ -(2x+y)$
"]]$\rm 0.5\;\rm mol\text{ C}{{\text{H}}_{\text{3}}}\text{COOH}\left( \text{g} \right)$与$\begin{array}{*{35}{l}} \text{1\;\rm mol} \\ \end{array}{{\text{ H}}_{\text{2}}}\left( \text{g} \right)$发生反应,达平衡时放热$ x\;\rm kJ$,$\begin{array}{*{35}{l}} \text{1\;\rm mol} \\ \end{array}\text{ C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH}\left( \text{g} \right)$与$\begin{array}{*{35}{l}} \text{1\;\rm mol} \\ \end{array}{{\text{ H}}_{\text{2}}}\text{O}\left( \text{g} \right)$发生反应,达平衡时吸热$ y\;\rm kJ$,则$\begin{array}{*{35}{l}} \text{1\;\rm mol} \\ \end{array}\text{ C}{{\text{H}}_{\text{3}}}\text{COOH}\left( \text{g} \right)$与$\begin{array}{*{35}{l}} \text{2\;\rm mol} \\ \end{array}{{\text{ H}}_{\text{2}}}\left( \text{g} \right)$完全反应生成$\begin{array}{*{35}{l}} \text{1\;\rm mol } \\ \end{array}\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH}\left( \text{g} \right)$与$\begin{array}{*{35}{l}} \text{1\;\rm mol } \\ \end{array}{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$,放热$ (2x+y)\;\rm kJ$,即$\Delta{{ {H}}_{\text{1}}} =- \left( {2x+y} \right)\text{ kJ/mol}$;
$\rm 250\;\rm ^\circ\rm C$下,恒压密闭容器中投入$\rm 2\;\rm mol\;H_{2}(g)$和$\rm 1\;\rm mol\; CH_{3}COOH(g)$,反应一段时间后,下列条件能判断反应达到平衡状态的是$(\quad\ \ \ \ )$。
混合气体的密度保持不变
","$\\rm CH_{3}CH_{2}OH$的体积分数不变
","${n\\rm (H_{2})}:n\\rm (CH_{3}COOH)=2: 1$
","反应体系放出的热量为$ 2x\\;\\rm kJ$
"]$\rm A$.根据质量守恒,混合气体的质量始终不变,容器体积发生改变,则恒容容器中混合气体的密度是变量,当混合气体的密度保持不变,说明反应达到平衡状态,$\rm A$正确;
$\rm B$.体积分数不变,则各组分的体积分数也保持不变,反应达平衡状态,$\rm B$正确;
$\rm C$.物质的量之比等于系数比,${n\rm (H_{2})}:n\rm (CH_{3}COOH)=2: 1$,不能说明其浓度不变,不能说明反应达平衡状态,$\rm C$错误;
$\rm D$.若只存在主反应,放出的热量为$ 2x\;\rm kJ$,说明是平衡状态,但存在副反应,体系放出的热量为$ 2x\;\rm kJ$不能说明是平衡状态,$\rm D$错误;
在${n\rm (H_{2})}:n\rm (CH_{3}COOH)=10: 1$时,$\rm 2\;MPa$下,平衡时$S($乙醇$)$和$S($乙酸乙酯$)$随温度的变化;$250\;\rm ^\circ\rm C$下,平衡时$S($乙醇$)$和$S($乙酸乙酯$)$随压强的变化如图所示:
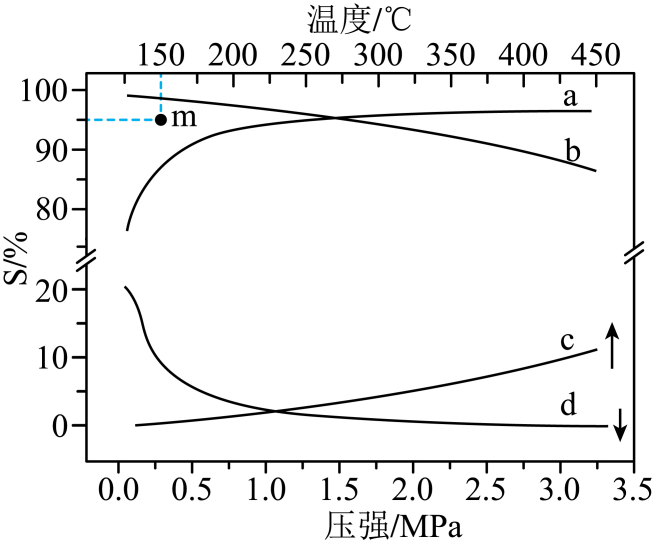
已知:$ {S}\left( 乙醇\right)=\dfrac{ {n}\left(乙醇 \right)}{ {n}\left(乙醇 \right) +2n \left( 乙酸乙酯\right)}\times 100\%$
①$\rm 250\;\rm ^\circ\rm C$下,乙醇选择性随压强变化的曲线是 。
②曲线$\rm b$变化的原因是 。
③$\rm 150\;\rm ^\circ\rm C$时,在催化剂作用下$\rm H_{2}(g)$和$\rm CH_{3}COOH(g)$反应一段时间后,乙醇的选择性位于$\rm m$点,不改变反应时间和温度,一定能提高乙醇选择性的措施 $\rm ($填一条$\rm )$。
$\\rm a$;主反应与副反应均为放热反应,温度升高,主反应和副反应的平衡均逆向移动,主反应逆向移动的程度大于副反应;使用对主反应催化活性更高的催化剂$\\rm ($或“增大压强”$\\rm )$
"]]①主反应为气体体积减小的放热反应,增大压强,平衡正向移动,乙醇的选择性上升,则$\rm 250\;\rm ^\circ\rm C$下,乙醇选择性随压强变化的曲线是$\rm a$;
②主反应和副反应均为放热反应,升高温度,平衡均逆向移动,主反应逆向移动的程度大于副反应,所以乙醇的选择性随着温度升高而减小;
③主反应为气体体积减小的反应,增大压强,反应正向移动,可以提高乙醇选择性,或选择主反应催化活性更高的催化剂;
一定温度和压强下,向初始体积为$\rm 1\;\rm L$的密闭容器中通入$\rm 2\;\rm mol\;\rm H_{2}(g)$和$\rm 1\;\rm mol\;\rm CH_{3}COOH(g)$,同时发生主反应和副反应,测得平衡时$n\rm [H_{2}O(g)]=0.8\;\rm mol$,体积减小$20\%$,则平衡时$c\rm (H_{2})=$ ,主反应的平衡常数$K=$ 。
$\\rm 1\\;\\rm mol/L$;$\\rm 2$
"]]平衡时$ n\rm [H_{2}O(g)]=0.8\;\rm mol$,体系中气体物质的量减小$\rm 20\%$,列化学平衡三段式,则:$\begin{matrix} {} &\rm {C}{{{H}}_{{3}}}{COOH(g)+} & \rm {2}{{{H}}_{{2}}}{(g)}\rightleftharpoons &\rm {C}{{{H}}_{{3}}}{C}{{{H}}_{{2}}}{OH(g)} \\起始 \rm {(mol)} & {1} & {2} & {0} \\变化 {\rm (mol)} & {x} & {2x} & {x} \\ 平衡{\rm (mol)} & {1-x} & {2-2x} & {x} \\ \end{matrix}\begin{matrix} +\rm {{{H}}_{{2}}}{O(g)} \\ {0} \\ {x} \\ {x} \\ \end{matrix}$,$\begin{matrix} {} & \rm {C}{{{H}}_{{3}}}{COOH(g)+} &\rm {C}{{{H}}_{{3}}}{C}{{{H}}_{{2}}}{OH(g)}\rightleftharpoons & \rm {C}{{{H}}_{{3}}}{COOC}{{{H}}_{{2}}}{C}{{{H}}_{{3}}}{(g)} \\起始 {\rm (mol)} & {1-x} & {x} & {0} \\变化 {\rm (mol)} & {y} & {y} & {y} \\ 平衡{\rm (mol)} & {1-x-y} & {x-y} & {y} \\ \end{matrix}\begin{matrix} +\rm {{{H}}_{{2}}}{O(g)} \\ {x} \\ {y} \\ {x+y} \\ \end{matrix}$
体积减小$\rm 20\%$,说明平衡时容器体积为$\rm 0.8\;\rm L$,平衡时混合气体总物质的量为$\rm 3\;\rm mol\times 80\%=2.4\;\rm mol$,副反应前后气体物质的量不变,主反应前后气体物质的量减小$x\rm \;mol$,且主反应化学计量数前后减小了$1\;\rm mol$,则$x=0.6$,根据平衡时,$n\rm [H_{2}O(g)]=0.8\;\rm mol$,则$x+y=0.8$,解得$x=0.6$,$y=0.2$,$c\rm (H_{2})=\dfrac{{2}-2\times 0.6}{0.8}\rm \;{mol/L=1\;\rm mol/L}$;平衡时$c\rm (CH_{3}CH_{2}OH)=\dfrac{{0}{.6-0}{.2}}{0.8}\rm \;{mol/L=0}{.5\;\rm mol/L}$,$c\rm (CH_{3}COOH)=\dfrac{{1-}0.6{-0}{.2}}{0.8}\rm \;{mol/L=0}{.25\;\rm mol/L}$,$c\rm (H_{2}O)=\dfrac{{0}{.8}}{{0}{.8}}\rm \;{mol/L=1\;\rm mol/L}$,$ K_{\rm c}=\dfrac{{c(乙醇)c(}{{{\rm H}}_{{2}}}{\rm O)}}{{c(乙酸)c(}{{{\rm H}}_{{2}}}{)}}\rm =\dfrac{0.{5}\times 1}{0.25\times {{1}^{2}}}=2$。
高中 | 化学平衡常数题目答案及解析(完整版)
