高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
一定条件下,水气变换反应$\text{CO}+{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{C}{{\text{O}}_{2}}+{{\text{H}}_{2}}$的中间产物是$\text{HCOOH}$。为探究该反应过程,研究$\text{HCOOH}$水溶液在密封石英管中的分解反应:
Ⅰ.$\text{HCOOH}\left( \text{aq} \right)\rightleftharpoons \text{CO}\left( \text{aq} \right)+{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\left(快 \right)\qquad\Delta {{H}_{1}}=+26.4\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
Ⅱ.$\text{HCOOH}\left( \text{aq} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{aq} \right)+{{\text{H}}_{2}}\left( \text{aq} \right)\left(慢 \right)\qquad\Delta {{H}_{2}}=-14.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
研究发现,在反应Ⅰ、Ⅱ中,${{\text{H}}^{+}}$仅对反应Ⅰ有催化作用;反应Ⅰ的速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
在该条件下,水气变换反应的焓变$\Delta {H}=$ 。
$\\Delta{ H=-41}{.2\\;\\rm kJ/mol}$
"]]根据盖斯定律,反应Ⅱ$\rm -$反应Ⅰ,得$\rm{CO}+{{{H}}_{2}}{O}\rightleftharpoons {C}{{{O}}_{2}}+{{{H}}_{2}}$,${ }\Delta{ H= }\Delta{ }{{{H}}_{{2}}}-\Delta{ }{{{H}}_{{1}}}=-14.8\;\rm {kJ}\cdot {mo}{{{l}}^{-1}}-\left( +26.4\;\rm {kJ}\cdot {mo}{{{l}}^{-1}} \right)={-41}{.2\;\rm kJ/mol}$;
反应Ⅰ的正反应速率方程为:$v=kc\left( {{\text{H}}^{+}} \right)c\left( \text{HCOOH} \right)$,$k$为反应速率常数。${{T}_{1}}$温度下,$\text{HCOOH}$电离平衡常数为$K_\text{a}$,当$\text{HCOOH}$平衡浓度为$ {x\;\rm mol}\cdot {{\text{L}}^{ {-1}}}$时,此时反应Ⅰ的速率$v=$ 。$\rm ($用$K_\text{a}$、${x}$、$k$的代数式来表示$\rm )$
${k}\\sqrt{{K_\\rm a}x} \\times{x}$
"]]$ T_{1}$温度时,$\rm HCOOH$建立电离平衡:$\rm HCOOH \rightleftharpoons \rm HCOO^{-}+H^{+}$,当$\rm HCOOH$平衡浓度为$x\;\rm mol/L$时,$\rm HCOOH$电离平衡常数为$K_{\rm a}= \dfrac{{c}\left(\rm {{{H}}^{+}} \right){c}\left(\rm {HCO}{{{O}}^{-}} \right)}{{c}\left(\rm {HCOOH} \right)}$,${c}\left(\rm {{{H}}^{+}} \right)\approx {c}\left( \rm {HCO}{{{O}}^{-}} \right)$,则 ${ c\rm (H^{+})}=\sqrt{{{{K}}_{\rm {a}}}{x}}$,$ v=k{c\rm (H^{+})}\cdot c{\rm (HCOOH)}=kx\sqrt{{{{K}}_{\rm {a}}}{x}}$;
①${{T}_{2}}$温度下,在密封石英管内完全充满$1.0\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\text{ HCOOH}$水溶液,使$\text{HCOOH}$分解,分解产物均完全溶于水。碳物种浓度与反应时间的变化关系如图所示$\rm ($忽略碳元素的其他存在形式$\rm )$。${{t}_{1}}$时刻$\text{CO}$、$\text{C}{{\text{O}}_{2}}$的浓度分别为$0.70\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$、$0.16\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,反应Ⅱ达平衡,测得${{\text{H}}_{2}}$的浓度为$0.50\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,反应Ⅱ的平衡常数为 。
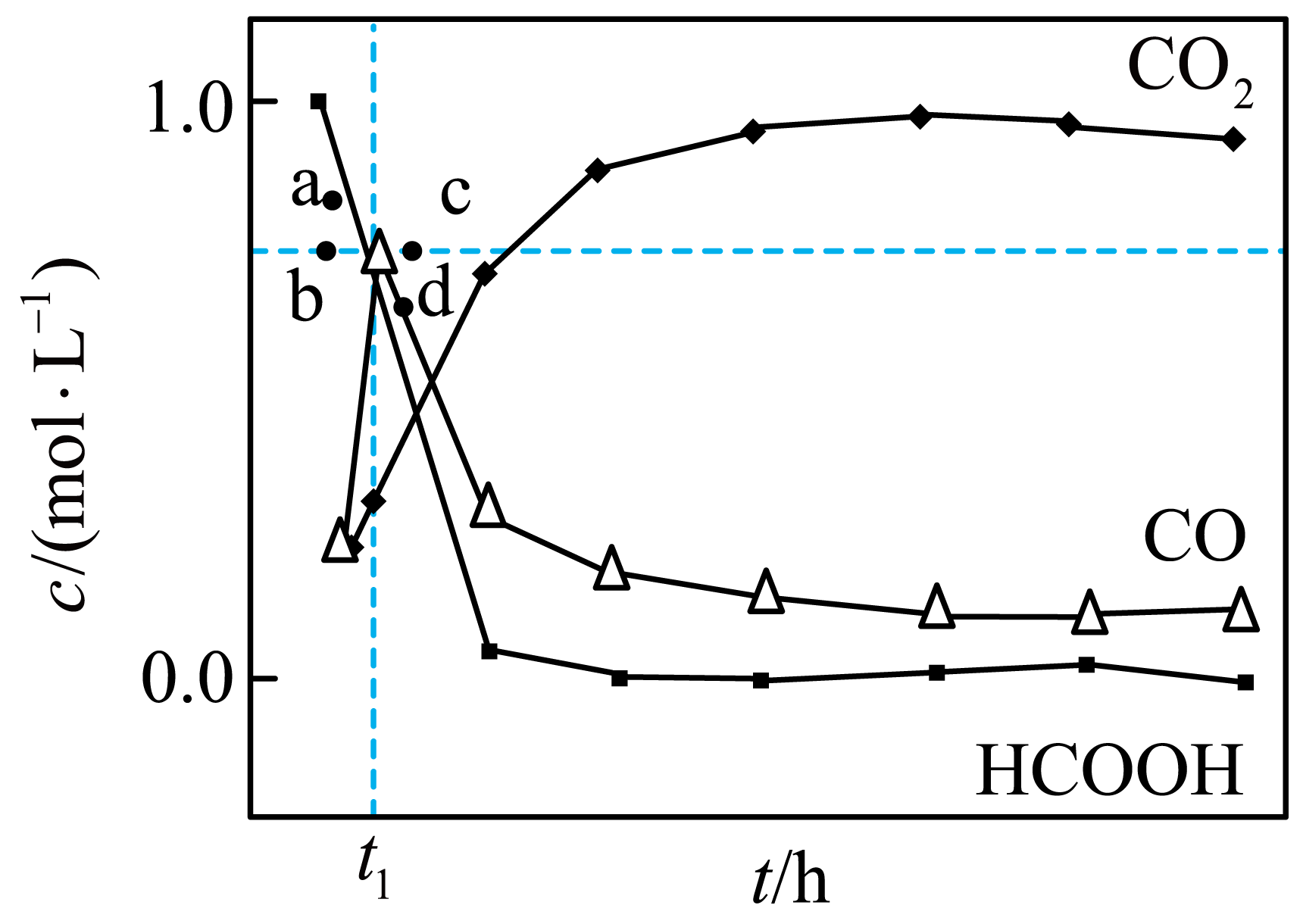
②在相同条件下,下列说法正确的是 。
$\rm A$.若反应起始时溶液中同时还含有$\rm 0.10\; \mathrm{mol} \cdot \mathrm{L}^{-1}$盐酸,则图示$\rm \text{a}$、$\rm \text{b}$、$\rm \text{c}$、$\rm \text{d}$中,$\rm \text{CO}$的峰值点可能是$\rm \text{a}$或$\rm \text{b}$
$\rm B$.若适当升高温度,则图示$\rm \text{a}$、$\rm \text{b}$、$\rm \text{c}$、$\rm \text{d}$中,$\rm \text{CO}$的峰值点可能是$\rm \text{a}$或$\rm \text{b}$
$\rm C$.与不含盐酸相比,$\rm \text{CO}$达到浓度峰值时,$\rm \text{C}{{\text{O}}_{2}}$浓度减小
$\rm D$.与不含盐酸相比,$\rm \text{CO}$达到浓度峰值时,$\dfrac{c\left( \text{CO} \right)}{c\left( \text{HCOOH} \right)}$的值减少
$\\rm 3$;$\\text{BC}$
"]]①$t_{1}$时刻时,$c\rm (CO)$达到最大值,说明此时反应$\rm I$达平衡状态,列三段式:$\begin{matrix} {} & \text{HCOOH}\left( \text{aq} \right) & \rightleftharpoons & \text{CO}\left( \text{aq} \right) & + & {{\text{H}}_{2}}\text{O}\left( \text{l} \right) \\起始浓度 \left( \text{mol}\cdot {{\text{L}}^{-1}} \right) & {} & {} & {} & {} & {} \\ 转化浓度\left( \text{mol}\cdot {{\text{L}}^{-1}} \right) & 0.7 & {} & 0.7 & {} & {} \\ 平衡浓度\left( \text{mol}\cdot {{\text{L}}^{-1}} \right) & {} & {} & {} & {} & {} \\ \end{matrix}$,$\begin{matrix} {} & \text{HCOOH}\left( \text{aq} \right) & \rightleftharpoons & \text{C}{{\text{O}}_{\text{2}}}\left( \text{aq} \right) & + & {{\text{H}}_{2}}\left( \text{aq} \right) \\ 起始浓度\left( \text{mol}\cdot {{\text{L}}^{-1}} \right) & {} & {} & {} & {} & {} \\ 转化浓度\left( \text{mol}\cdot {{\text{L}}^{-1}} \right) & 0.16 & {} & 0.16 & {} & 0.16 \\平衡浓度 \left( \text{mol}\cdot {{\text{L}}^{-1}} \right) & {} & {} & {} & {} & {} \\ \end{matrix}$,故$t_{1}$时刻$c\rm (HCOOH)=1.0-0.70-0.16=0.14\;mol·L^{-1}$,
$K{\rm (I)}= \dfrac{{c}\left(\rm {CO} \right)}{{c}\left(\rm {HCOOH} \right)}\rm =\dfrac{{0}{.70}}{{0}{.14}}\rm =5$。$ t_{1}$时刻$\rm →$反应$\rm II$达平衡过程,$\rm CO$的浓度在减小,说明反应Ⅰ逆向移动,反应Ⅰ生成了$a\;\rm mol·L^{-1}\;{HCOOH}\rm $,反应Ⅱ又生成了$\rm 0.34\;\rm mol/L$的$\rm H_{2}$,列三段式:$\begin{matrix} {} &\rm {HCOOH}\left(\rm {aq} \right) & \rightleftharpoons &\rm {CO}\left(\rm {aq} \right) & + & \rm {{{H}}_{{2}}}{O}\left(\rm {l} \right) \\起始浓度 \left(\rm {mol}\cdot {{{L}}^{{-1}}} \right) & {0}{.14} & {} & {0}{.7} & {} & {} \\ 转化浓度\left(\rm {mol}\cdot {{{L}}^{{-1}}} \right) & {a} & {} & {a} & {} & {} \\平衡浓度 \left(\rm {mol}\cdot {{{L}}^{{-1}}} \right) & {0}{.14+a-0}{.34} & {} & {0}{.7-a} & {} & {} \\ \end{matrix}$,$\begin{matrix} {} &\rm {HCOOH}\left(\rm {aq} \right) & \rightleftharpoons &\rm {C}{{{O}}_{{2}}}\left(\rm {aq} \right) & + & \rm {{{H}}_{{2}}}\left(\rm {aq} \right) \\ 起始浓度 \left(\rm {mol}\cdot {{{L}}^{{-1}}} \right) & {0}{.14} & {} & {0}{.16} & {} & {0}{.16} \\转化浓度 \left(\rm {mol}\cdot {{{L}}^{{-1}}} \right) & {0}{.34} & {} & {0}{.34} & {} & {0}{.34} \\ 平衡浓度\left(\rm {mol}\cdot {{{L}}^{{-1}}} \right) & {0}{.14+a-0}{.34} & {} & {0}{.5} & {} & {0}{.5} \\ \end{matrix}$,${ K\rm (I)}=\dfrac{{c}\left(\rm {CO} \right)}{{c}\left(\rm {HCOOH} \right)} =\dfrac{{0}{.7-a}}{{0}{.14+a-0}{.34}}\rm =5$,解得$ a=\dfrac{1.7}{6}\rm \;mol$,$ K(Ⅱ )=\dfrac{{c}\left(\rm {C}{{{O}}_{{2}}} \right){c}\left(\rm {{{H}}_{{2}}} \right)}{{c}\left(\rm {HCOOH} \right)}=\dfrac{0.5\times 0.5}{{0}{.14+}\dfrac{1.7}{6}{-0}{.34}}=3$;
②$\rm A$.$\rm H^{+}$对反应$\rm I$起催化作用,加快反应$\rm I$的反应速率,缩短到达平衡所需时间,故$\rm CO$浓度峰值提前,由于时间缩短,反应Ⅱ消耗的$\rm HCOOH$减小,体系中$\rm HCOOH$浓度增大,导致$\rm CO$浓度大于$ t_{1}$时刻的峰值,故$c\rm (CO)$最有可能在$\rm a$处达到峰值,$\rm A$错误;
$\rm B$.若适当升高温度,反应Ⅰ正向移动,则图示$\rm {a}$、$\rm {b}$、$\rm {c}$、$\rm {d}$中,$\rm {CO}$的峰值点可能是$\rm {a}$或$\rm {b}$,$\rm B$正确;
$\rm C$.与不含盐酸相比,$\rm {CO}$达到浓度峰值时,$\rm CO$浓度峰值提前,$\rm {C}{{{O}}_{2}}$浓度减小,$\rm C$正确;
$\rm D$.与不含盐酸相比,$\rm {CO}$达到浓度峰值时,温度不变,平衡常数不变,则${ K\rm(I)} =\dfrac{{c}\left(\rm {CO} \right)}{{c}\left(\rm {HCOOH} \right)}$的值不变,$\rm D$错误;
工业上,水气变化的反应历程包含反应物分子在催化剂表面的吸附$\rm ($快速$\rm )$、反应物及产物分子脱吸附等过程。随着温度升高,在催化剂活性温度范围内,该反应的反应速率先增大后减小,其速率减小的原因 。
吸附为放热过程,温度过高,平衡逆移;催化剂表面反应物浓度$\\rm ($量$\\rm )$减小,速率减慢
"]]水气变化的反应历程包含反应物分子在催化剂表面的吸附$\rm ($快速$\rm )$、反应物及产物分子脱吸附等过程,吸附为放热过程,温度过高,平衡逆移;催化剂表面反应物浓度$\rm ($量$\rm )$减小,速率减慢。
高中 | 化学平衡常数题目答案及解析(完整版)
