高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
氯化六氨合钴$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$在染料、电镀、医学等方面有广泛的应用。实验室以$\text{CoC}{{\text{l}}_{2}}$为原料进行制备,实验操作步骤如下:
步骤$\rm 1$:实验制备装置如图所示,向$\rm 100\;\rm mL$三颈烧瓶内加入$\rm 4.5\;\rm g$研细的$\text{CoC}{{\text{l}}_{\text{2}}}$、$\rm 3\;\rm g\text{N}{{\text{H}}_{\text{4}}}\text{Cl}$和$\rm 5\;\rm mL$水,加热溶解后加入$\rm 0.3\;\rm g$活性炭作催化剂。
步骤$\rm 2$:水浴加热至$\rm 333\;K$,烧瓶中加入浓氨水、${{\text{H}}_{2}}{{\text{O}}_{2}}$溶液两种试剂,获得$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$。
已知:${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]}^{2+}}$具有较强还原性,氧化性,$\mathrm{Co}^{3+}\gt \mathrm{H}_2 \mathrm{O}_2$
回答下列问题:
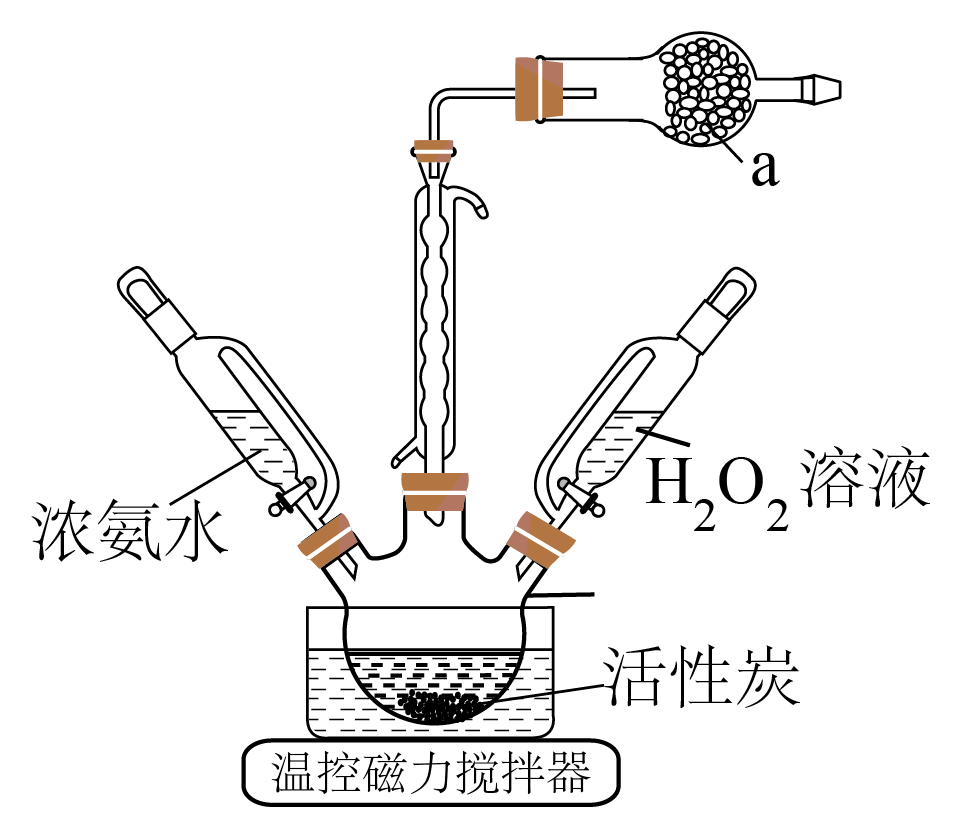
仪器$\rm a$中盛装的试剂是 。
$\\rm P_{2}O_{5}$或无水氯化钙
"]]氨水易挥发且加热易分解,实验过程中会产生污染性的气体$\rm NH_{3}$,用$\rm P_{2}O_{5}$或无水氯化钙来吸收。
步骤$\rm 2$中试剂加入的合理顺序为 。
$\rm a$.先加浓氨水后加过氧化氢溶液 $\rm b$.先加过氧化氢溶液后加浓氨水
$\\rm a$
"]]若先加$\rm H_{2}O_{2}$溶液,由已知可知,氧化性$\rm Co^{3+}$大于$\rm H_{2}O_{2}$,$\rm H_{2}O_{2}$不能将$\rm Co^{2+}$氧化为$\rm Co^{3+}$;若先加氨水,形成$\rm [Co(NH_{3})_{6}]^{2+}$具有较强的还原性,易被$\rm H_{2}O_{2}$氧化为$\rm [Co(NH_{3})_{6}]^{3+}$;
步骤$\rm 2$中“水浴加热至$\rm 333\;K$”,温度不宜过高的原因是 。
温度太高会使$\\rm [Co(NH_{3})_{6}]Cl_{3}$和$\\rm H_{2}O_{2}$分解,还会增加浓氨水挥发
"]]$\rm 333\;K$是$\rm 60\;\rm ^\circ\rm C$,加热可以加快生成目标产物的速率,但加热温度不能太高,是因为温度太高会使$\rm [Co(NH_{3})_{6}]Cl_{3}$和$\rm H_{2}O_{2}$分解,还会增加浓氨水挥发;
写出三颈烧瓶中发生反应的化学方程式为 。
$\\rm 2CoCl_{2}+2NH_{4}Cl+10NH_{3}·H_{2}O+H_{2}O_{2}=2[Co(NH_{3})_{6}]Cl_{3}↓+12H_{2}O$
"]]根据反应装置图中所加物质来写反应物,根据目标产物来写生成物,然后利用氧化还原反应得失电子守恒配平,可得化学方程式为$\rm 2CoCl_{2}+2NH_{4}Cl+10NH_{3}·H_{2}O+H_{2}O_{2}=2[Co(NH_{3})_{6}]Cl_{3}↓+12H_{2}O$;
补充后续步骤$\rm 3$的实验方案:取出三颈烧瓶中的混合物,用冰水冷却, ,过滤,用无水乙醇洗涤滤渣,干燥后得到$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$晶体。$\rm ($已知$\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{6}} \right]\text{C}{{\text{l}}_{3}}$难溶于冷水,易溶于热的稀盐酸。实验中可选择的试剂有热的稀盐酸、冰水$\rm )$
往滤渣中加入热盐酸,趁热过滤,滤液用冰水冷却结晶
"]]结合信息可知,将三颈烧瓶中所得混合物过滤,用冰水冷却后,过滤。在滤渣$\rm ([Co(NH_{3})_{6}]Cl_{3}$晶体和活性炭$\rm )$中加入热盐酸,$\rm [Co(NH_{3})_{6}]Cl_{3}$晶体溶于热稀盐酸中,趁热过滤除去活性炭,滤液用冰水冷却,使$\rm [Co(NH_{3})_{6}]Cl_{3}$晶体析出,充分静置后过滤,用无水乙醇洗涤$\rm 2\sim 3$次,干燥得到产品;
在没有活性炭存在时,能得到一种化学式为$\text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{C}{{\text{l}}_{3}}$的纯净物。测得$1\text{ mol Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{C}{{\text{l}}_{3}}$与足量的硝酸银溶液反应生成$\rm 2\;\rm mol\text{ AgCl}$,该配合物内界的化学式为 。
${{\\left[ \\text{Co}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{5}}\\text{Cl} \\right]}^{2+}}$
"]]测得$1\text{ mol Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{C}{{\text{l}}_{3}}$与足量的硝酸银溶液反应生成$\rm 2\;\rm mol\text{ AgCl}$,该配合物内界的化学式为${{\left[ \text{Co}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{5}}\text{Cl} \right]}^{2+}}$。
高中 | 配合物理论题目答案及解析(完整版)
