高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
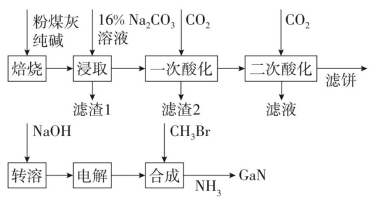
金属镓被称为“电子工业脊梁”,性质与铝相似,金属活动性介于锌和铁之间。氮化镓是$\rm 5G$技术中广泛应用的新型半导体材料,利用粉煤灰(主要成分为$\rm Ga_{2}O_{3}$、$\rm Al_{2}O_{3}$、$\rm SiO_{2}$,还有少量$\rm Fe_{2}O_{3}$等杂质)制备氮化镓流程如下:
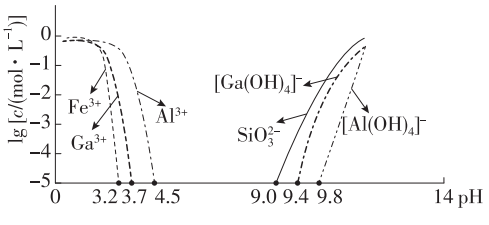
已知:常温下,相关元素可溶性组分物质的量浓度$c$与$\rm pH$的关系如图所示。当溶液中可溶组分浓度$c⩽10^{-5}\rm \ mol\cdot L^{-1}$时,可认为已除尽。
“焙烧”的目的是将$\rm Ga_{2}O_{3}$转化为$\rm NaGaO_{2}$,该反应的化学方程式为 。
“焙烧”的目的是将$\rm Ga_{2}O_{3}$和碳酸钠反应生成$\rm NaGaO_{2}$和二氧化碳,该反应的化学方程式为$\rm Ga_{2}O_{3}+Na_{2}CO_{3}\begin{matrix} \underline{\underline{焙烧}} \\ {} \\\end{matrix}2NaGaO_{2}+CO_{2}\uparrow$。
“滤渣$1$”主要成分为 。
“焙烧”时氧化铁不反应,加入碱性溶液碳酸钠,氧化铁不反应不溶解,故过滤后“滤渣$1$”主要成分为$\rm Fe_{2}O_{3}$。
“二次酸化”的$\rm pH\approx $ ,其中$\rm [Ga(OH)_{4}]^{-}$发生反应的离子方程式为 。
“二次酸化”主要生成氢氧化镓沉淀,由图像可知$c\rm \{ [Ga(OH)_{4}]^{-}\} ⩽10^{-5}\rm \ mol\cdot L^{-1}$时,$\rm pH$为$9.4$,其中$\rm [Ga(OH)_{4}]^{-}$和二氧化碳反应的离子方程式为$\rm 2[Ga(OH)_{4}]^{-}+CO_{2}=2Ga(OH)_{3}\downarrow +CO^{2-}_{3}+H_{2}O$。
“电解”可得金属$\rm Ga$,写出阴极电极反应式: 。
“电解”可得金属$\rm Ga$,阴极区$\rm [Ga(OH)_{4}]^{-}$发生还原反应得到金属镓,电极反应式为$\rm [Ga(OH)_{4}]^{-}+3e^{-}=\ Ga+4OH^{-}$。
“合成”得到的三甲基镓与$\rm NH_{3}$反应时,两者物质的量之比为 。
“合成”得到的三甲基镓与$\rm NH_{3}$反应的化学方程式为$\rm Ga(CH_{3})_{3}+NH_{3}=GaN+3CH_{4}$,故两者物质的量之比为$1:1$。
常温下,反应$\rm Ga(OH)_{3}+OH^{-}\rightleftharpoons [Ga(OH)_{4}]^{-}$的平衡常数$K=$ 。
由图可知,$c\rm \{ [Ga(OH)_{4}]^{-}\} =10^{-5}\ mol\cdot L^{-1}$时,$\rm pH$为$9.4$,则$\rm pOH=4.6$,故常温下,反应$\rm Ga(OH)_{3}+OH^{-}\rightleftharpoons [Ga(OH)_{4}]^{-}$的平衡常数$K=\dfrac {c\rm \{ [Ga(OH)_{4}]^{-1}\} }{c{\rm (OH^{-})}}=\dfrac {10^{-5}}{10^{-4.6}}=10^{-0.4}$。
高中 | 化学平衡常数题目答案及解析(完整版)
