高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
工业上除去$\text{S}{{\text{O}}_{2}}$尾气有多种方法。
常见的烟道气中除去$\text{S}{{\text{O}}_{2}}$的方法之一:$2\text{CO}(\text{g})+\text{S}{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{C}{{\text{O}}_{2}}(\text{g})+\text{S}(\text{l})(\Delta H\lt 0)$
该反应的平衡常数表达式为 。若保持其他条件不变,缩小反应容器的体积,平衡常数将会 $\rm ($选填“变大”、“变小”或“不变”$\rm )$。
$K=\\dfrac{{{c}^{2}}\\left( \\text{C}{{\\text{O}}_{2}} \\right)}{{{c}^{2}}\\left( \\text{CO} \\right)c\\left( \\text{S}{{\\text{O}}_{2}} \\right)}$ ; 不变
"]]$2\text{CO}(\text{g})+\text{S}{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{C}{{\text{O}}_{2}}(\text{g})+\text{S}(\text{l})$,反应是气体体积减小的放热反应,平衡常数$K=\dfrac{{{c}^{2}}\left( \text{C}{{\text{O}}_{2}} \right)}{{{c}^{2}}\left( \text{CO} \right)c\left( \text{S}{{\text{O}}_{2}} \right)}$,平衡常数随温度变化,缩小反应容器的体积,平衡正向进行,平衡常数不变;
如图是平衡时$\text{S}{{\text{O}}_{2}}$的质量在不同温度下随压强的变化曲线,判断:${{T}_{1}}$ ${{T}_{2}}\rm ($选填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$。
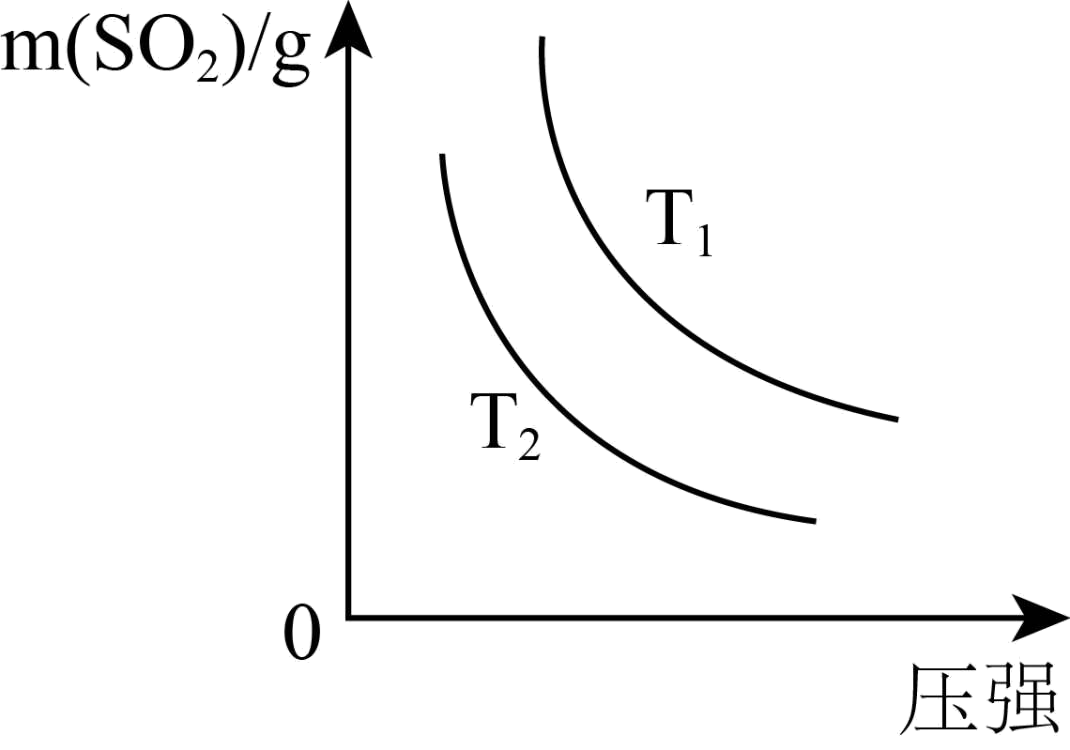
$\\rm \\gt $
"]]反应为放热反应,相同压强下,温度越高平衡逆向进行,二氧化硫质量增加,${{T}_{1}}\gt {{T}_{2}}$;
若在$\rm 2\;\rm L$的密闭容器中进行上述反应,经测定在$\rm 5\;\rm min$内气体的质量减小了$\rm 1.6\;\rm g$,则$\rm 0\sim 5\;\rm min$的平均反应速率$v\left( \text{C}{{\text{O}}_{2}} \right)=$ 。
$\\rm 0.01$ $\\rm mol/(L\\cdot min)$
"]]若在$\rm 2\;\rm L$的密闭容器中进行上述反应,结合化学方程式定量关系计算,$2\text{CO}(\text{g})+\text{S}{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{C}{{\text{O}}_{2}}(\text{g})+\text{S}(\text{l})$,生成$\rm 2\;\rm mol$二氧化碳气体质量减少$\rm 32\;\rm g$,经测定在$\rm 5\;\rm min$内气体的质量减小了$\rm 1.6\;\rm g$,反应的二氧化碳为$\rm 0.1$ $\rm mol$,浓度是$\rm 0.05$ $\rm mol/L$,反应速率$v=0.05\text{ mol/L}\div 5\text{ min}=0.01\text{ mol/}\left( \text{L}\cdot \text{min} \right)$。
高中 | 化学平衡常数题目答案及解析(完整版)
