高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成$\rm S$和$\text{S}{{\text{O}}_{2}}$。某小组利用如下装置,用$\text{S}{{\text{O}}_{2}}$、$\text{N}{{\text{a}}_{2}}\text{S}$和$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$来制备$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$,同时产生了一种无色无味气体。
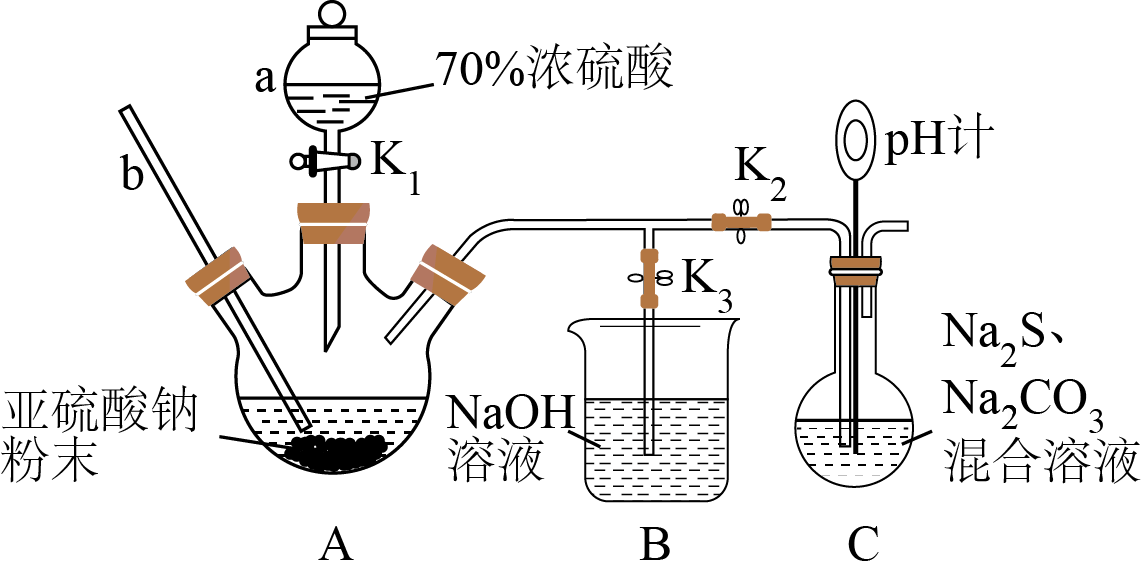
根据以上信息写出制备$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$的化学方程式 。
$\\rm 2Na_{2}S+4SO_{2}+Na_{2}CO_{3}=3Na_{2}S_{2}O_{3}+CO_{2}$
"]]用$\text{S}{{\text{O}}_{2}}$、$\text{N}{{\text{a}}_{2}}\text{S}$和$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$来制备$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$,同时产生了一种无色无味气体即$\rm CO_{2}$,制备$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$的化学方程式$\rm 2Na_{2}S+4SO_{2}+Na_{2}CO_{3}=3Na_{2}S_{2}O_{3}+CO_{2}$;
硫代硫酸根$\rm ({{\text{S}}_{2}}\text{O}_{3}^{2-}\rm )$可看作是$\text{SO}_{4}^{2-}$中的一个$\rm O$原子被$\rm S$原子取代的产物。$\text{SO}_{4}^{2-}$的中心原子价层电子对数为 ,${{\text{S}}_{2}}\text{O}_{3}^{2-}$的空间结构是 形。
$\\rm 4$ ;四面体
"]]$\text{SO}_{4}^{2-}$的中心原子价层电子对数为$\rm 4+\dfrac{6+2-2\times 4}{2}\rm =4$,${{\text{S}}_{2}}\text{O}_{3}^{2-}$和$\text{SO}_{4}^{2-}$互为等电子体,结构相似,$\text{SO}_{4}^{2-}$中心$\rm S$原子价层电子对个数为$\rm 4$且不含孤电子对,则$\text{SO}_{4}^{2-}$的空间结构为正四面体形,则${{\text{S}}_{2}}\text{O}_{3}^{2-}$的空间结构为四面体形;
$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$的制备过程:检验装置的气密性,将所需药品加入各仪器装置;打开${{\text{K}}_{2}}$,关闭${{\text{K}}_{3}}$,调节${{\text{K}}_{1}}$使硫酸缓缓滴下,导管口有气泡冒出,$\rm pH$计读数逐渐减小,当$\rm pH$计读数接近$\rm 7$时,必须立即打开${{\text{K}}_{3}}$,关闭${{\text{K}}_{1}}$、${{\text{K}}_{2}}$,原因是 。
防止$\\rm SO_{2}$过量,溶液呈酸性
"]]$\rm Na_{2}S_{2}O_{3}$在酸性溶液中易生成$\rm S$和$\rm SO_{2}$,当$\rm pH$计读数接近$\rm 7$时,立即打开$\rm K_{3}$,关闭$\rm K_{1}$、$\rm K_{2}$,防止$\rm SO_{2}$过量,溶液呈酸性,造成$\rm Na_{2}S_{2}O_{3}$在酸性溶液中生成$\rm S$和$\rm SO_{2}$,降低产率,故答案为:防止$\rm SO_{2}$过量,溶液呈酸性;
将装置$\rm C$中所得溶液经一系列操作,最后洗涤、干燥,得到$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$样品。洗涤时为尽可能避免产品损失,应选用的试剂是$(\quad\ \ \ \ )$。
水
","氢氧化钠溶液
","稀盐酸
","乙醇
"]$\rm Na_{2}S_{2}O_{3}$易溶于水和氢氧化钠溶液,能与酸反应生成$\rm S$和$\rm SO_{2}$,但难溶于乙醇,可选择无水乙醇洗涤$\rm Na_{2}S_{2}O_{3}$样品,避免产品损失;
制备$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$的上述装置有明显缺陷,改进措施是 。
工业上常用硫化物来处理废水中的重金属离子,室温时,几种重金属离子的硫化物的溶度积常数如表:
| 金属硫化物 | $\rm FeS$ | $\rm PbS$ | $\rm CuS$ | $\rm HgS$ |
| ${{K}_{\text{sp}}}$ | $6.3\times {{10}^{-18}}$ | $1.0\times {{10}^{-28}}$ | $6.3\times {{10}^{-36}}$ | $1.6\times {{10}^{-52}}$ |
在$\\rm C$后连接一个盛放浓$\\rm NaOH$溶液的洗气瓶
"]]$\rm SO_{2}$是有毒气体,逸出会污染空气,所以该制备实验中要进行尾气处理,防止多余的$\rm SO_{2}$气体逸出,污染空气,制备$\rm Na_{2}S_{2}O_{3}$的上述装置中明显缺陷是无尾气处理装置,改进措施为:在$\rm C$后连接一个盛放浓$\rm NaOH$溶液的洗气瓶;
向物质的量浓度相同的$\text{F}{{\text{e}}^{2+}}$、$\text{P}{{\text{b}}^{2+}}$、$\text{C}{{\text{u}}^{2+}}$、$\text{H}{{\text{g}}^{2+}}$的混合稀溶液中,逐滴加入$\text{N}{{\text{a}}_{2}}\text{S}$稀溶液,首先沉淀的离子是$(\quad\ \ \ \ )$。
$\\text{F}{{\\text{e}}^{2+}}$
","$\\text{P}{{\\text{b}}^{2+}}$
","$\\text{C}{{\\text{u}}^{2+}}$
","$\\text{H}{{\\text{g}}^{2+}}$
"]相同类型的难溶电解质,溶度积越小,越易生成沉淀,由表中数据可知最先生成沉淀的是$\rm Hg^{2+}$;
用$\text{N}{{\text{a}}_{2}}\text{S}$溶液沉淀废水中$\text{P}{{\text{b}}^{2+}}$,为使$\text{P}{{\text{b}}^{2+}}$沉淀完全$\left[ c\left( \text{P}{{\text{b}}^{2+}} \right)\le 1\times {{10}^{-5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}} \right]$,则应满足溶液中$c\left( {{\text{S}}^{2-}} \right)\ge $ $\mathrm{mol} \cdot \mathrm{L}^{-1}$。
$\\rm 1.0\\times 10^{-23}$
"]]由$K_{\rm sp}=c(\rm Pb^{2+})$∙$c(\rm S^{2-})$可知,为使$\rm Pb^{2+}$沉淀完全$[c(\rm Pb^{2+})≤ 1\times 10^{-5}\;\rm mol\cdot L^{-1}]$,则应满足溶液中$ c(\rm S^{2-})≥\dfrac{1.0\times {{10}^{-28}}}{1.0\times {{10}^{-5}}}\rm mol/L=1.0\times 10^{-23}\;\rm mol/L$。
反应$\text{C}{{\text{u}}^{2+}}(\text{aq})+\text{FeS}(\text{s})\rightleftharpoons \text{F}{{\text{e}}^{2+}}(\text{aq})+\text{CuS}(\text{s})$的平衡常数$K$的值为 。
$\\rm 1.0\\times 10^{18}$
"]]反应$\rm Cu^{2+}(aq)+FeS(s)⇌Fe^{2+}(aq)+CuS(s)$的平衡常数$K=\dfrac{{{{K}}_{\text{sp}}}\left( \text{FeS} \right)}{{{{K}}_{\text{sp}}}\left( \text{CuS} \right)}=\dfrac{6.3\times {{10}^{-18}}}{6.3\times {{10}^{-36}}}\rm =1.0\times 10^{18}$。
高中 | 化学平衡常数题目答案及解析(完整版)
