高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
习近平总书记在党的二十大报告中指出“实现碳达峰、碳中和是一场广泛而深刻的经济社会系统性变革”。其中研发$\rm CO_{2}$的转化技术是行之有效的手段。
已知,$\rm CO_{2}$生产甲醇过程主要发生以下反应:
反应$\rm I$. $\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{3}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-48.97\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
反应Ⅱ.$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{2}}=41.17\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
反应Ⅲ.$\text{CO}\left( \text{g} \right)+2{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)\quad \Delta {{H}_{3}}=-90.14\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
假设仅发生反应Ⅲ,在一定温度下体积为$\rm 2$ $\rm L$的恒容密闭容器中,投入$\rm 4$ $\rm mol$ $\rm CO$和$\rm 8$ $\rm mol$ $\rm H_{2}$,经过$t\text{ min}$达平衡,$\rm CO$平衡转化率为$\rm 90\%$,保持其余条件不变,再投入$\rm 0.6$ $\rm mol$ $\rm H_{2}$及$\rm 1.4$ $\rm mol$ $\rm CH_{3}OH$后,平衡将 移动。$\rm ($写出具体计算过程$\rm )$
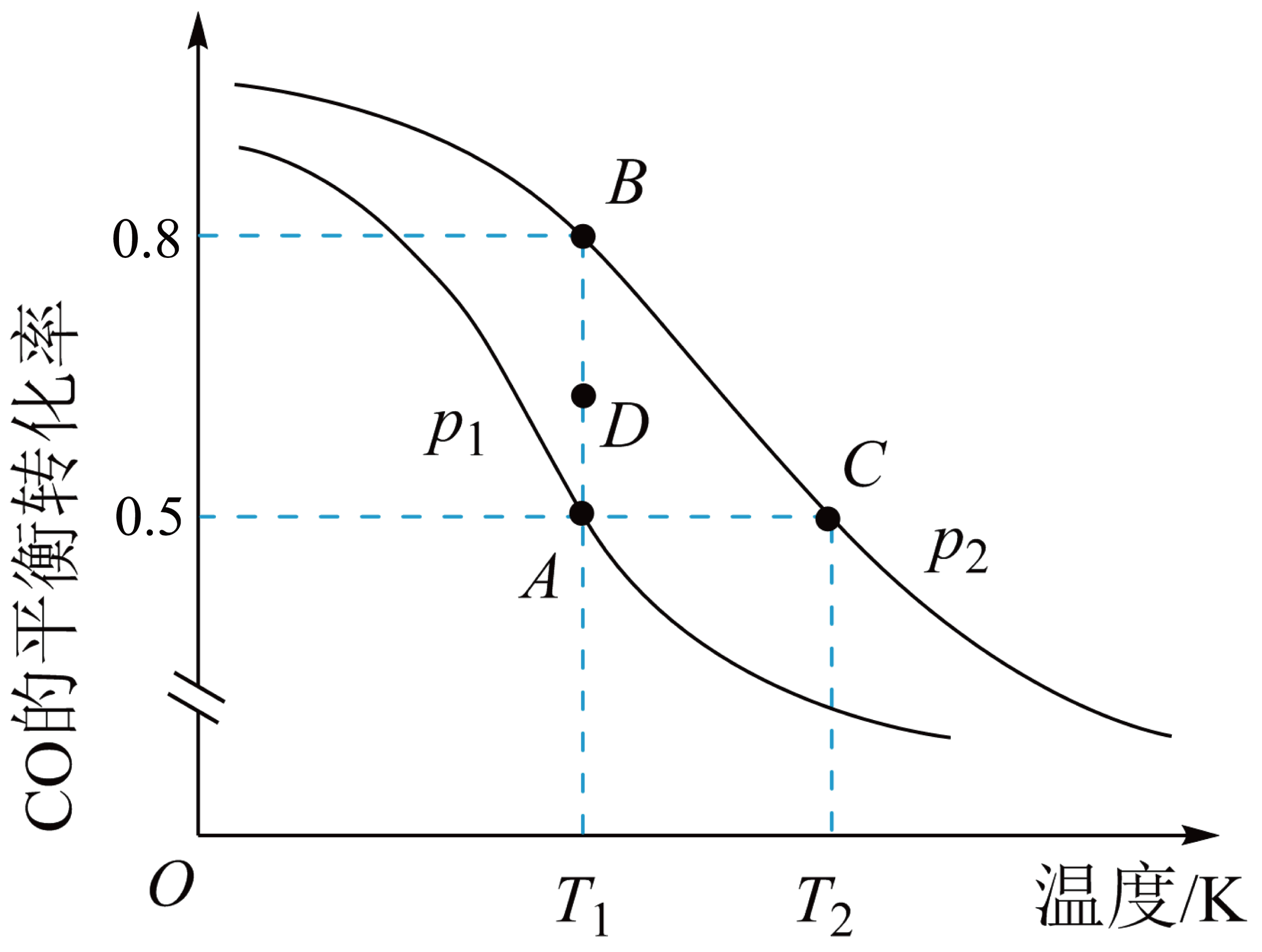
在某密闭容器中进行该反应,$\rm CO$的平衡转化率与温度的关系如图所示:
正向
"]]根据题中所给物质的量,建立三段式如下:
$\begin{matrix} {} \\起始 \text{(mol)} \\转化 \text{(mol)} \\ 平衡\text{(mol)} \\ \end{matrix}\begin{matrix} \text{CO}\left( \text{g} \right) \\ \text{4}\,\text{mol} \\ \text{3}\text{.6}\,\text{mol} \\ \text{0}\text{.4}\,\text{mol} \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right) \\ \text{8}\,\text{mol} \\ \text{7}\text{.2}\,\text{mol} \\ \text{0}\text{.8}\,\text{mol} \\ \end{matrix}\begin{matrix} \rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right) \\ \text{0}\,\text{mol} \\ \text{3}\text{.6}\,\text{mol} \\ \text{3}\text{.6}\,\text{mol} \\ \end{matrix}$
容器为体积为$\rm 2$ $\rm L$,可得$K=\dfrac{c\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)}{c\left( \text{CO} \right){{c}^{\text{2}}}\left( {{\text{H}}_{\text{2}}} \right)}=\dfrac{\dfrac{3.6}{2}}{\dfrac{0.4}{2}\times {{\left( \dfrac{0.8}{2} \right)}^{2}}}=56.25$ ,若再向该容器中$\rm 0.6$ $\rm mol$ $\rm H_{2}$及$\rm 1.4$ $\rm mol$ $\rm CH_{3}OH$,则$Q=\dfrac{c\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)}{c\left( \text{CO} \right){{c}^{\text{2}}}\left( {{\text{H}}_{\text{2}}} \right)}=\dfrac{\dfrac{3.6+1.4}{2}}{\dfrac{0.4}{2}\times {{\left( \dfrac{0.8+0.6}{2} \right)}^{2}}}\approx 25.51\lt K$,所以平衡正向移动,平衡时$\rm CO$浓度增大。
$\rm A$、$\rm B$、$\rm C$三点平衡常数${{K}_{\text{A}}}$、${{K}_{\text{B}}}$、${{K}_{\text{C}}}$的大小关系为 。
${{K}_{\\text{A}}}={{K}_{\\text{B}}}\\gt {{K}_{\\text{C}}}$
"]]由题图可知,温度升高,$\rm CO$的平衡转化率降低,说明升高温度平衡逆向移动,所以该反应是放热反应,温度升高,平衡常数减小,且平衡常数只与温度有关,由于温度$\rm A=B$ $\rm \lt $ $\rm C$,所以${{K}_{\text{A}}}={{K}_{\text{B}}}\gt {{K}_{\text{C}}}$;
$T_{1}$时,由$\rm D$点到$\rm B$点过程中,正、逆反应速率之间的关系:${{v}_{正}}$ ${{v}_{逆}}\,$。$\rm ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$
$\\rm \\gt $
"]]相同温度下,$\rm D$点的转化率低于平衡点$\rm B$点的转化率,此时反应向正反应方向进行,因此${{v}_{正}}\gt {{v}_{逆}}$;
向某恒温恒压密闭容器中充入$\rm 1$ $\rm mol$ $\rm CO(g)$和$\rm 2$ $\rm mol$ $\rm H_{2}(g)$,下列能说明反应Ⅲ达到平衡的是 。
$\rm A$.容器内混合气体的密度不再改变
$\rm B$.容器内混合气体的平均相对分子质量不再改变
$\rm C$.两种反应物转化率的比值不再改变
$\rm D$.${{v}_{正}}\left( \text{CO} \right)=2{{v}_{逆}}\left( {{\text{H}}_{2}} \right)$
$\\rm AB$
"]]$\rm A$.该反应过程中气体的总质量不变,总体积减小,混合气体的密度增大,当容器内混合气体的密度不再改变时说明反应达到平衡,$\rm A$正确;
$\rm B$.该反应过程中气体的总质量不变,总物质的量减小,混合气体的平均摩尔质量增大,当容器内混合气体的平均相对分子质量不再改变时说明反应达到平衡,$\rm B$正确;
$\rm C$.在$\rm 2\;\rm L$恒容密闭容器中充入$\rm 2$ $\rm mol$ $\rm CO$和$\rm 4$ $\rm mol$ $\rm H_{2}$,反应过程中$\rm CO$和$\rm H_{2}$转化率的比值相等,当两种反应物转化率的比值不再改变时,不能说明反应达到平衡,$\rm C$错误;
$\rm D$.${{v}_{正}}\left( \text{CO} \right)=2\text{ }{{v}_{逆}}\left( {{\text{H}}_{2}} \right)$时不能说明正逆反应速率相等,不能说明反应达到平衡,$\rm D$错误。
写出反应Ⅲ的平衡常数表达式 。
$K=\\dfrac{c\\left( \\text{C}{{\\text{H}}_{\\text{3}}}\\text{OH} \\right)}{c\\left( \\text{CO} \\right){{c}^{2}}\\left( {{\\text{H}}_{2}} \\right)}$
"]]反应Ⅲ的平衡常数表达式为$K=\dfrac{c\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)}{c\left( \text{CO} \right){{c}^{2}}\left( {{\text{H}}_{2}} \right)}$。
高中 | 化学平衡常数题目答案及解析(完整版)
