高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
通过电化学、热化学等方法,将$\text{C}{{\text{O}}_{2}}$转化为$\text{HCOOH}$等化学品,是实现“双碳”目标的途径之一。如下图,某小组采用电化学方法将$\text{C}{{\text{O}}_{2}}$转化为$\text{HCOOH}$。
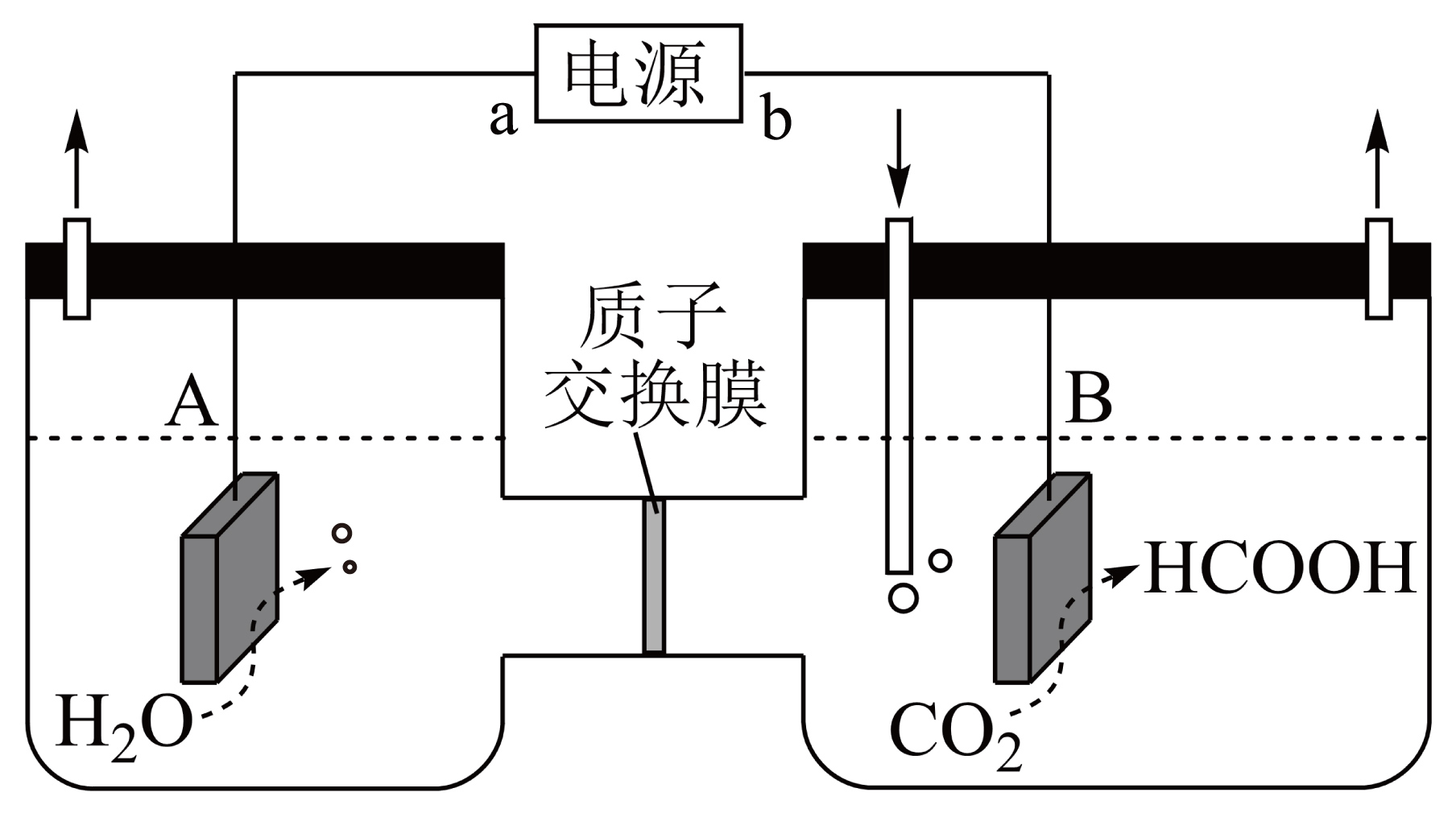
$\rm ($不定项$\rm )$关于该装置及参与反应的物质,下列说法正确的是 。
$\rm A$.电源的$\rm a$为负极
$\rm B$.电解过程中,电解液中的$\rm {{\text{H}}^{+}}$从$\rm A$极室移向$\rm B$极室
$\rm C$.$\rm \text{Fe}$可用作$\rm B$极室的电极材料
$\rm D$.$\rm \text{C}{{\text{O}}_{2}}$和$\rm \text{HCOOH}$中碳原子的杂化方式不同
$\\rm BD$
"]]$\rm A$.由分析知$\rm A$极为阳极,则电源的$\rm a$为正极,$\rm A$错误;
$\rm B$.电解过程中,阳离子从阳极移向阴极,即电解液中的$\rm {{\text{H}}^{+}}$从$\rm A$极室移向$\rm B$极室,$\rm B$正确;
$\rm C$.$\rm B$极室电解生成甲酸会与铁反应,故$\rm \text{Fe}$不可用作$\rm B$极室的电极材料,$\rm C$错误;
$\rm D$.$\rm \text{C}{{\text{O}}_{2}}$中碳原子是$\rm sp$杂化,$\rm \text{HCOOH}$中碳原子是$\rm sp^{2}$杂化,故碳原子杂化方式不同,$\rm D$正确。
电极$\rm B$上的电极反应式是 。当生成$9.2\,\text{g}$甲酸时,标况下$\rm A$极室产生的气体的体积为 $\rm \;\rm L$。
该小组后续改用热化学方法将$\text{C}{{\text{O}}_{2}}$转化为$\text{HCOOH}$,相关热化学方程式如下:
Ⅰ:$\text{C}\left( \text{s} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{\text{1}}}\text{=-393}\text{.5}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
Ⅱ:$\text{C}\left( \text{s} \right)+{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)=\text{HCOOH}\left( \text{g} \right)\quad \Delta {{H}_{\text{2}}}=-\text{378}\text{.7}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
Ⅲ:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{HCOOH}\left( \text{g} \right)$
$\\mathrm{CO}_{2}+2 \\mathrm{H}^{+}+2 \\mathrm{e}^{-}=\\mathrm{HCOOH}$ ; $\\rm 2.24$
"]]①电极$\rm B$是阴极,则电极反应式是$\mathrm{CO}_{2}+2 \mathrm{H}^{+}+2 \mathrm{e}^{-}=\mathrm{HCOOH}$;生成$9.2\,\text{g}$甲酸时,即$\rm 0.2$ $\rm mol$甲酸,则转移电子为$\rm 0.4$ $\rm mol$,所以$\rm A$极室产生的氧气的物质的量为$\rm 0.1$ $\rm mol$,则标况下体积为$\rm 2.24$ $\rm L$;
$\Delta {{H}_{3}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
$\\rm +14.8$
"]]由方程式可知反应Ⅲ等于反应Ⅱ$\rm -$反应Ⅰ,对应反应热$\Delta {{H}_{3}}=\Delta {{H}_{2}}-\Delta {{H}_{1}}=-378\text{ }.7\,\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}+393\text{ }.5\,\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=+14.8\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
反应Ⅲ在某恒温、恒容的密闭容器中进行,其平衡常数的数值$K=2.4\times {{10}^{-8}}$。结合以上信息,试从化学反应的自发性角度解释反应Ⅲ的$K$值较小的原因 。条件不变,当$\text{C}{{\text{O}}_{2}}$和${{\text{H}}_{2}}$的投料浓度均为$1.0\,\text{mol}\cdot {{\text{L}}^{-1}}$,则$\text{C}{{\text{O}}_{2}}$的平衡转化率为 。$\rm ($保留$\rm 2$位有效数字$\rm )$
为提高效率,该研究小组根据文献优化了热化学方法。在如下图密闭装置中充分搅拌催化剂$\rm M$的$\text{DMSO}\rm ($有机溶剂$\rm )$溶液,$\text{C}{{\text{O}}_{2}}$和${{\text{H}}_{2}}$在溶液中反应制备$\text{HCOOH}$,反应过程中保持$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$和${{\text{H}}_{2}}\left( \text{g} \right)$的压强不变。总反应$\text{C}{{\text{O}}_{2}}+{{\text{H}}_{2}}\rightleftharpoons \text{HCOOH}$的反应速率为$v$,反应机理如下列三个基元反应,其活化能${{E}_{2}}\lt {{E}_{1}}\lt {{E}_{3}}\rm ($不考虑催化剂活性降低或丧失$\rm )$。
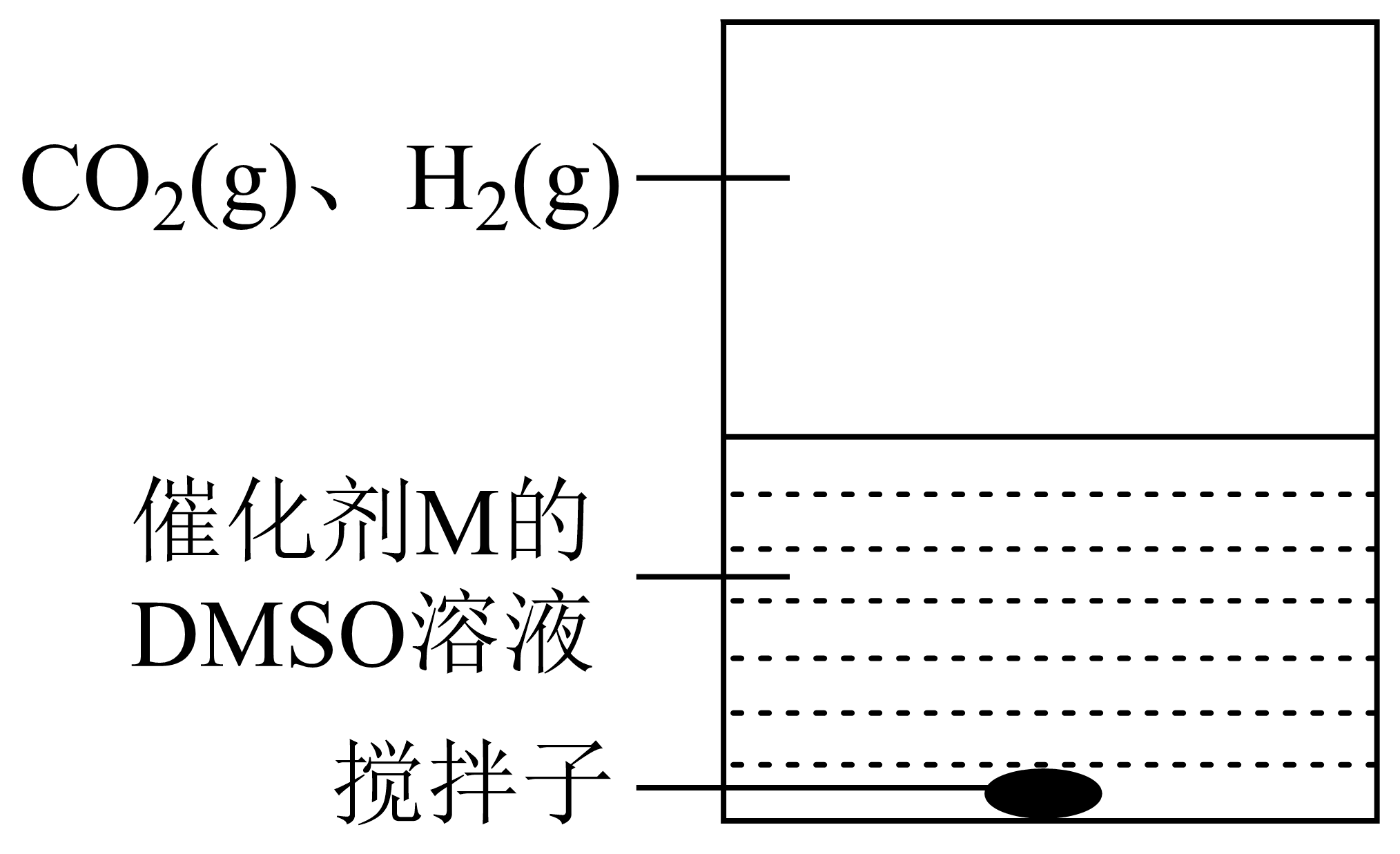
Ⅳ:$\text{M}+\text{C}{{\text{O}}_{2}}\rightleftharpoons \text{Q }{{E}_{\text{1}}}$
Ⅴ:$\text{Q}+{{\text{H}}_{2}}\rightleftharpoons \text{L }{{E}_{\text{2}}}$
Ⅵ:$\text{L}\rightleftharpoons \text{M}+\text{HCOOH }\,{{E}_{\text{3}}}$
反应Ⅲ是熵碱且吸热的反应,$\\Delta H-T\\Delta S\\gt 0$,不能自发进行 ; $2.4\\times {{10}^{-6}}\\%$
"]]①反应Ⅲ的$\Delta {{H}_{3}}\gt 0$,且反应后气体个数减少,所以$\Delta S\lt 0$,则$\Delta H-T\Delta S\gt 0$,不能自发进行;②根据三段式,设转化的$\rm CO_{2}$为$x$,则:$\begin{matrix} {} & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & \text{HCOOH}\left( \text{g} \right) & {} & {} \\起始浓度 \text{mol/L} & \text{1} & {} & \text{1} & {} & \text{0} & {} & {} \\变化浓度 \text{mol/L} & x & {} & x & {} & x & {} & {} \\平衡浓度 \text{mol/L} & 1-x & {} & 1-x & {} & x & {} & {} \\ \end{matrix}$,则$K=\dfrac{c(\text{HCOOH})}{c(\text{C}{{\text{O}}_{2}})\cdot c({{\text{H}}_{2}})}=\dfrac{x}{{{(1-x)}^{2}}}=2.4\times {{10}^{-8}}$,$x\approx 2.4\times {{10}^{-8}}$,则转化率$\rm =\dfrac{\text{2}\text{.4}\times \text{1}{{\text{0}}^{\text{-8}}}}{\text{1}}\times \text{100 }\!\!\%\!\!\text{ =2}\text{.4}\times \text{1}{{\text{0}}^{\text{-6}}}\%$;
$\rm ($不定项$\rm )$催化剂$\rm M$足量条件下,下列说法正确的是 。
$\rm A$.$v$与$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的压强有关
$\rm B$.$v$与溶液中溶解${{\text{H}}_{2}}$的浓度无关
$\rm C$.反应Ⅴ是该反应的决速步
$\rm D$.在溶液中加入有机碱,可提高$\text{C}{{\text{O}}_{2}}$转化率
$\\rm AD$
"]]$\rm A$.$v$与$\rm CO_{2}(g)$的压强有关,压强越大,溶液中$\rm CO_{2}$的浓度越大,$v$越大,$\rm A$正确;
$\rm B$.$v$与溶液中溶解$\rm H_{2}$的浓度有关,氢气浓度越大,速率越快,$\rm B$错误;
$\rm C$.已知活化能${{E}_{2}}\lt {{E}_{1}}\lt {{E}_{3}}$,反应Ⅳ和Ⅴ是快反应,而Ⅵ是慢反应(决速步骤),$\rm C$错误;
$\rm D$.在溶液中加入的有机碱会与$\rm HCOOH$反应,使得三个平衡正向移动,可提高$\rm CO_{2}$转化率,$\rm D$正确。
实验测得:在$298\,\text{K}$,${p}\left( \text{C}{{\text{O}}_{\text{2}}} \right)={p}\left( {{\text{H}}_{\text{2}}} \right)=\text{2}\,\text{MPa}$下,反应速率$v$随催化剂$\rm M$浓度$c$变化如图。$c\le {{c}_{0}}$时,$v$随$c$增大而增大:$c\gt {{c}_{0}}$时,$v$不再显著增大。请解释原因 。
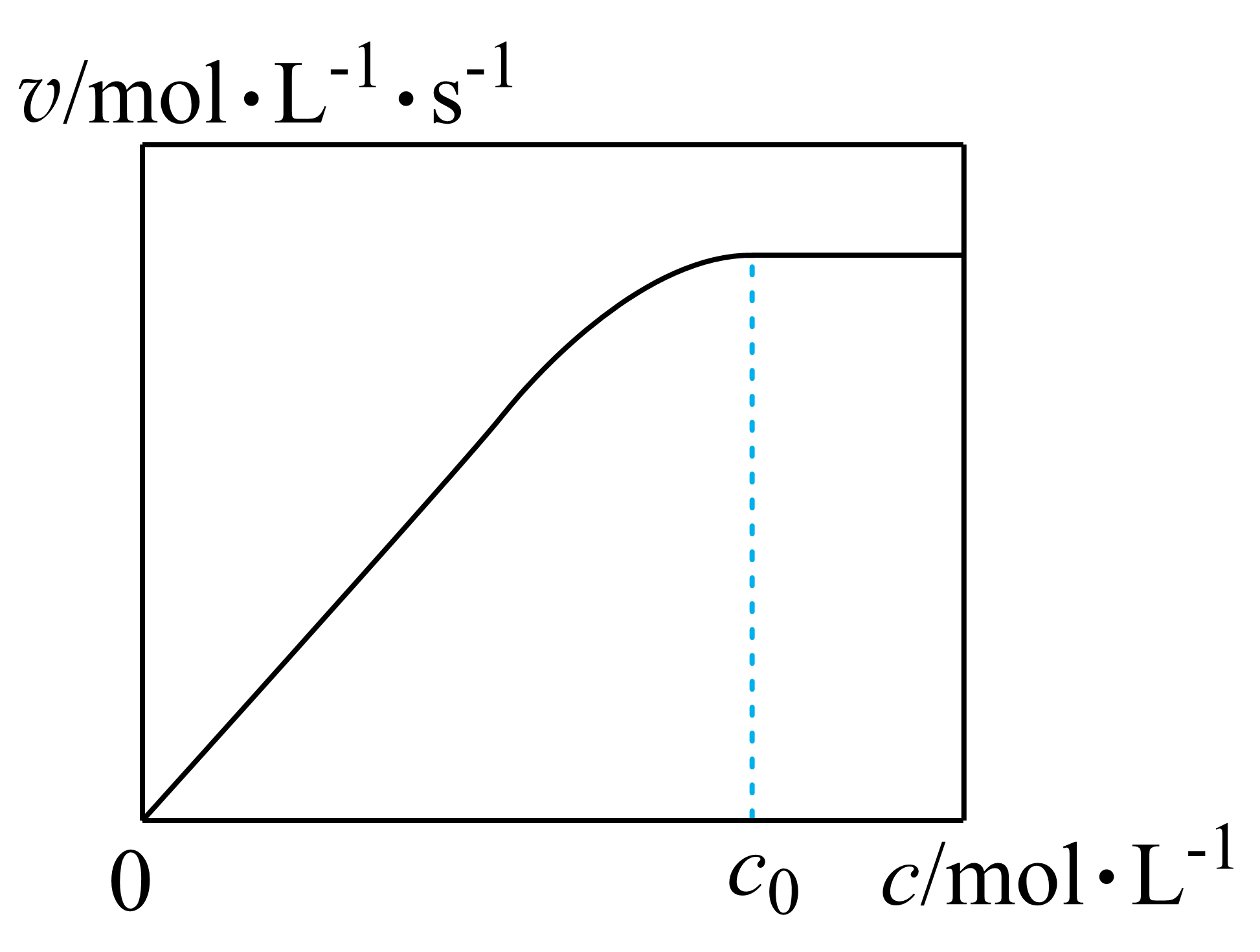
当$c\\le {{c}_{0}}$时,$v$随$c$增大而增大,因$\\rm M$是基元反应Ⅰ的反应物$\\rm ($直接影响基元反应Ⅴ中反应物$\\rm L$的生成$)c\\gt {{c}_{0}}$时,$v$不再显著增加,而是受限于$\\text{C}{{\\text{O}}_{2}}\\left( \\text{g} \\right)$和${{\\text{H}}_{2}}\\left( \\text{g} \\right)$在溶液中的溶解速度$\\rm ($或浓度$\\rm )$
"]]各反应的活化能,反应$\rm IV$为决速步骤,但$\rm L$的浓度取决于反应$\rm V$和$\rm VI$,所以速率与催化剂$\rm M$的浓度和反应物$\rm CO_{2}$、$\rm H_{2}$的浓度有关。当$c≤c_{0}$时,催化剂$\rm M$的活性位点数量不够,速率取决于催化剂$\rm M$的浓度,即$v$随$c$增大而增大,因$\rm M$是基元反应$\rm IV$的反应物$\rm ($直接影 响基元反应$\rm VI$中反应物$\rm L$的生成$\rm )$;$c\gt {{c}_{0}}$时,催化剂$\rm M$的活性位点数量足够,速率取决于反应物$\rm CO_{2}$和$\rm H_{2}$的浓度,即$v$不再显著增加,而是受限于$\rm CO_{2}(g)$和$\rm H_{2}$ $\rm (g)$在溶液中的溶解速度$\rm ($或浓度$\rm )$。
用氨水吸收制备的$\text{HCOOH}$,可得到$\text{HCOON}{{\text{H}}_{4}}$溶液$\rm [$已知:电离常数${{K}_{\text{b}}}\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)\text{=1}\text{.8}\times \text{1}{{\text{0}}^{\text{-5}}}$,${{K}_{\text{a}}}\left( \text{HCOOH} \right)\text{=1}\text{.8}\times \text{1}{{\text{0}}^{\text{-4}}}\rm ]$。$0.10\,\text{mol}\cdot {{\text{L}}^{-1}}$的甲酸铵溶液中所含离子浓度从大到小为 。测得某吸收液为$0.1\,\text{mol}\cdot {{\text{L}}^{-1}}$氨水和$0.18\,\text{mol}\cdot {{\text{L}}^{-1}}$甲酸铵的混合溶液,该混合溶液的$\text{pH}=$ 。
$c\\left( \\text{HCO}{{\\text{O}}^{-}} \\right)\\gt c\\left( \\text{NH}_{\\text{4}}^{+} \\right)\\gt c\\left( {{\\text{H}}^{+}} \\right)\\gt c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$ ; $\\rm 9$
"]]$0.10 \mathrm{mol} \cdot \mathrm{L}^{-1}$的甲酸铵溶液中铵根离子和甲酸根离子都会水解,由于${{K}_{\text{b}}}\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)\text{=1}\text{.8}\times \text{1}{{\text{0}}^{\text{-5}}}\lt {{K}_{\text{a}}}\left( \text{HCOOH} \right)\text{=1}\text{.8}\times \text{1}{{\text{0}}^{\text{-4}}}$,所以铵根离子水解程度更大,溶液显酸性,则所含离子浓度从大到小为$c\left( \text{HCO}{{\text{O}}^{-}} \right)\gt c\left( \text{NH}_{\text{4}}^{+} \right)\gt c\left( {{\text{H}}^{+}} \right)\gt c\left( \text{O}{{\text{H}}^{-}} \right)$;甲酸铵水解反应为:${{\text{H}}_{\text{2}}}\text{O}+\text{HCO}{{\text{O}}^{-}}+\text{NH}_{\text{4}}^{+}\rightleftharpoons \text{HCOOH}+\text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O}$, $0.1\,\text{mol}\cdot {{\text{L}}^{-1}}$氨水和$0.18\,\text{mol}\cdot {{\text{L}}^{-1}}$甲酸铵的混合溶液,导致甲酸铵水解受抑制,由于电离和水解都很微弱,所以溶液中$c\text{(NH}_{{4}}^{+}\text{)}\approx \text{0}{.18\;\rm mol/L}$,$c\text{(N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O)}\approx \text{0}\text{.1}\,\text{mol/L}$,根据${{K}_{\text{b}}}\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)=\dfrac{c\text{(O}{{\text{H}}^{-}}\text{)}\cdot c\text{(NH}_{\text{4}}^{+}\text{)}}{c(\text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O)}}\text{=1}\text{.8}\times \text{1}{{\text{0}}^{\text{-5}}}$,得$c\text{(O}{{\text{H}}^{-}}\text{)=1}{{\text{0}}^{\text{-5}}}\,\text{mol/L}$,所以该混合溶液的$\text{pH}=\rm 9$。
高中 | 化学平衡常数题目答案及解析(完整版)
