高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
以${\rm NO}_{x}$为主要成分的雾霾综合治理是当前重要的研究课题,其中汽车尾气的处理尤为重要。请回答下列问题:
某$\rm MOFs$多孔材料孔径大小和形状恰好将$\rm N_{2}O_{4}$“固定”,能高选择性吸附$\rm NO_{2}$。废气中的$\rm NO_{2}$被吸附后,经处理能全部转化为$\rm HNO_{3}$。原理示意图如下。
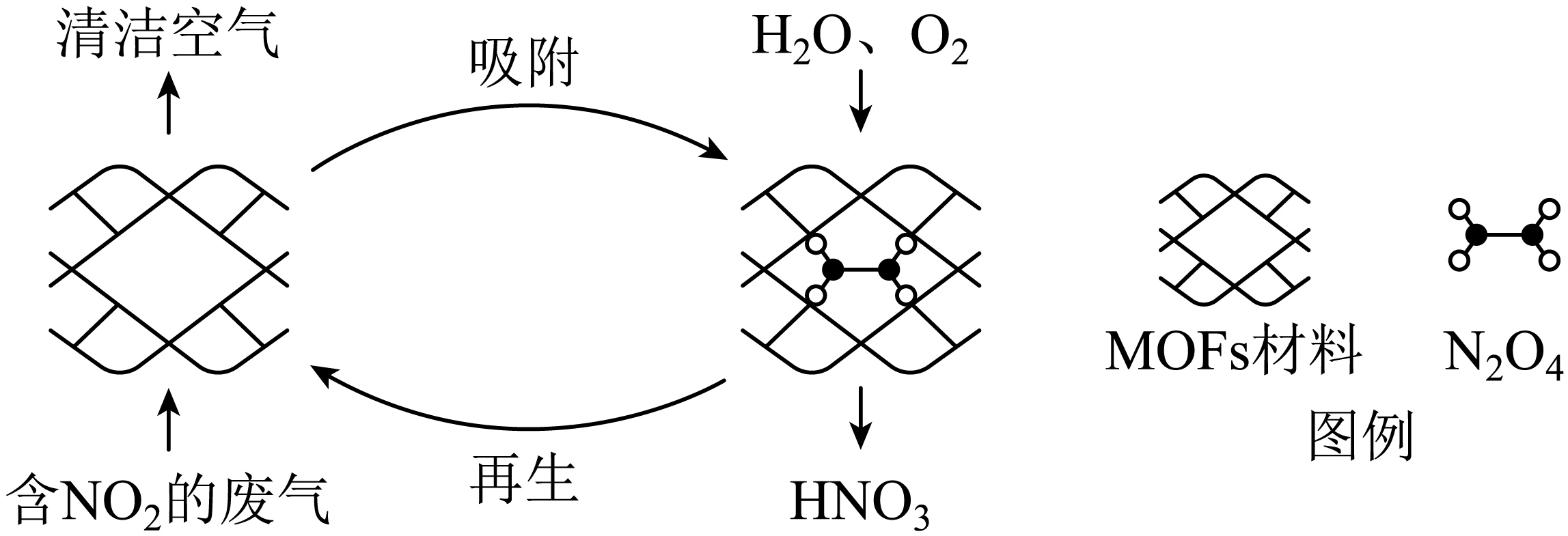
已知:${\rm 2NO_{2}(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,N_{2}O_{4}(g)}\quad\Delta H\lt 0$,下列说法错误的是
$\rm A$.温度升高时不利于$\rm NO_{2}$吸附
$\rm B$.多孔材料“固定”$\rm N_{2}O_{4}$,促进$\rm 2NO_{2}(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,N_{2}O_{4}(g)$平衡正向移动
$\rm C$.转化为$\rm HNO_{3}$的反应是$\rm 2N_{2}O_{4}+O_{2}+2H_{2}O=4HNO_{3}$
$\rm D$.每获得$\rm 0.4\ mol\ HNO_{3}$时,转移电子的数目为$\rm 6.02\times 10^{22}$
$\\rm D$
"]]温度升高时$\rm NO_{2}$动能大,不利于$\rm NO_{2}$吸附,$\rm A$正确。
多孔材料“固定”$\rm N_{2}O_{4}$,使$\rm N_{2}O_{4}$分离,促进$\rm 2NO_{2}(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,N_{2}O_{4}(g)$平衡正向移动,$\rm B$正确。
$\rm N_{2}O_{4}$与$\rm O_{2}$和水反应生成硝酸,转化为$\rm HNO_{3}$的反应是$\rm 2N_{2}O_{4}+O_{2}+2H_{2}O=4HNO_{3}$,$\rm C$正确。
根据方程式$\rm 2N_{2}O_{4}+O_{2}+2H_{2}O=4HNO_{3}$得知,生成$\rm 4\ mol$硝酸转移$\rm 4\ mol$电子,每获得$\rm 0.4\ mol\ HNO_{3}$时,转移电子的数目为$\rm 0.4\times 6.02\times 10^{23}$电子,$\rm D$错误。
$\rm NO$和$\rm CO$均为汽车尾气的成分,在催化转换器中可发生反应:$\rm 2CO(g)+2NO(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,N_{2}(g)+2CO_{2}(g)$,已知该反应为自发反应,则该反应的反应热$\Delta H$ $\rm 0($填“$\rm \gt $”或“$\rm \lt $”或“$\rm =$”$\rm )$。
$\\rm \\lt $
"]]$\rm 2CO(g)+2NO(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,N_{2}(g)+2CO_{2}(g)$,该反应为自发反应,$\Delta G=\Delta H-T\times \Delta S\lt 0$,则该反应的$\Delta S\lt 0$,故$\Delta H$也应该小于$\rm 0$。
已知:${\rm N_{2}(g)+O_{2}(g)=2NO(g)}\quad\Delta H=a\ \rm kJ\cdot mol^{-1}$
${\rm C(s)+O_{2}(g)=CO_{2}(g)}\quad\Delta H=b\ \rm kJ\cdot mol^{-1}$
${\rm 2C(s)+O_{2}(g)=2CO(g)}\quad\Delta H=c\ \rm kJ\cdot mol^{-1}$
则${\rm 2CO(g)+2NO(g)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,N_{2}(g)+2CO_{2}(g)}\quad\Delta H=$ $\rm \ kJ\cdot mol^{-1}($用含$a$、$b$、$c$的表达式表示$\rm )$。
$-(a+c-2b)$或$2b-a-c$
"]]由题干信息可知,反应$\rm I$:${\rm N_{2}(g)+O_{2}(g)=2NO(g)}\quad\Delta H_{1}=a\ \rm kJ/mol$反应$\rm II$:${\rm C(s)+O_{2}(g)=CO_{2}(g)}\quad\Delta H_{2}=b\ \rm kJ/mol$反应$\rm III$:${\rm 2C(s)+O_{2}(g)=2CO(g)}\quad\Delta H_{3}=c\ \rm kJ/mol$,目标反应:$\rm 2CO(g)+2NO(g)=N_{2}(g)+2CO_{2}(g)$可由$\rm 2II-I-III$,根据盖斯定律可知:$\Delta H=2\Delta H_{2}-\Delta H_{1}-\Delta H_{3}=(2b-a-c)\ \rm kJ/mol$。
一定温度下,将$\rm 2\ mol\ CO$、$\rm 4\ mol\ NO$充入$\rm 2\ L$密闭容器。$\rm 5\ min$到达平衡,测得$\rm N_{2}$的物质的量为$\rm 0.5\ mol$,则:
①$\rm 5\ min$内$v{\rm (NO)}=$ 。该反应的平衡常数的数值为$K=$ $\rm ($保留两位小数$\rm )$。
②该条件下,可判断此反应到达平衡的标志是
$\rm A$.单位时间内,消耗$\rm 2\ mol\ CO$同时形成$\rm 1\ mol\ N_{2}$
$\rm B$.混合气体的平均相对分子质量不再改变
$\rm C$.混合气体的密度不再改变
$\rm D$.$\rm CO$与$\rm NO$的转化率比值不再改变
$\\rm 0.1\\ mol/(L\\cdot min)$;$\\rm 0.11$;$\\rm B$
"]]$\rm 5\ min$到达平衡,测得$\rm N_{2}$的物质的量为$\rm 0.5\ mol$,$v{\rm (N_{2})}=\rm \dfrac{0.5\ mol}{2\ L\times 5\ min}=0.05\ mol/(L\cdot min)$,$\rm NO$系数是$\rm N_{2}$的$\rm 2$倍,速率也是$\rm N_{2}$的$\rm 2$倍,$v{\rm (NO)}=0.1\rm \ mol/(L\cdot min)$。
$\rm \begin{matrix} {} & \rm 2CO(g) & + & \rm 2NO(g) & = &\rm {{N}_{2}}(g) & + & \rm 2C{{O}_{2}}(g) \\起始量 & 2 & {} & 4 & {} & 0 & {} & 0 \\转化量 & 1 & {} & 1 & {} & 0.5 & {} & 1 \\平衡量 & 1 & {} & 3 & {} & 0.5 & {} & 1 \\ \end{matrix}$
平衡浓度分别是$c{\rm (CO)}=0.5\rm \ mol\cdot L^{-1}\cdot min^{-1}$,$c{\rm (NO)}=1.5\rm \ mol\cdot L^{-1}\cdot min^{-1}$,$c{\rm (N_{2})}=0.25\rm \ mol\cdot L^{-1}\cdot min^{-1}$,$c{\rm (CO_{2})}=0.5\rm \ mol\cdot L^{-1}\cdot min^{-1}$,$K=\dfrac{0.25\times {{0.5}^{2}}}{{{1.5}^{2}}\times {{0.5}^{2}}}=0.11$。
判断达到平衡状态按照正逆反应速率相等,变量不变的原则分析。
单位时间内,消耗$\rm 2\ mol\ CO$同时形成$\rm 1\ mol\ N_{2}$表示的是正反应方向,不符合正逆反应速率相等,$\rm A$错误。
混合气体的平均相对分子质量不再改变符合变量不变,可以证明可逆反应达到平衡状态,$\rm B$正确。
混合气体密度是定值,混合气体的密度不再改变不能说明达到平衡状态,$\rm C$错误。
$\rm CO$与$\rm NO$的转化率比值是定值,不是变量,不符合变量不变,$\rm D$错误。
某研究小组探究催化剂Ⅰ、Ⅱ对$\rm CO$、$\rm NO$转化的影响。将$\rm CO$和$\rm NO$以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中$\rm N_{2}$的含量,从而确定尾气脱氮率$\rm ($即$\rm NO$的转化率$\rm )$,结果如图所示:
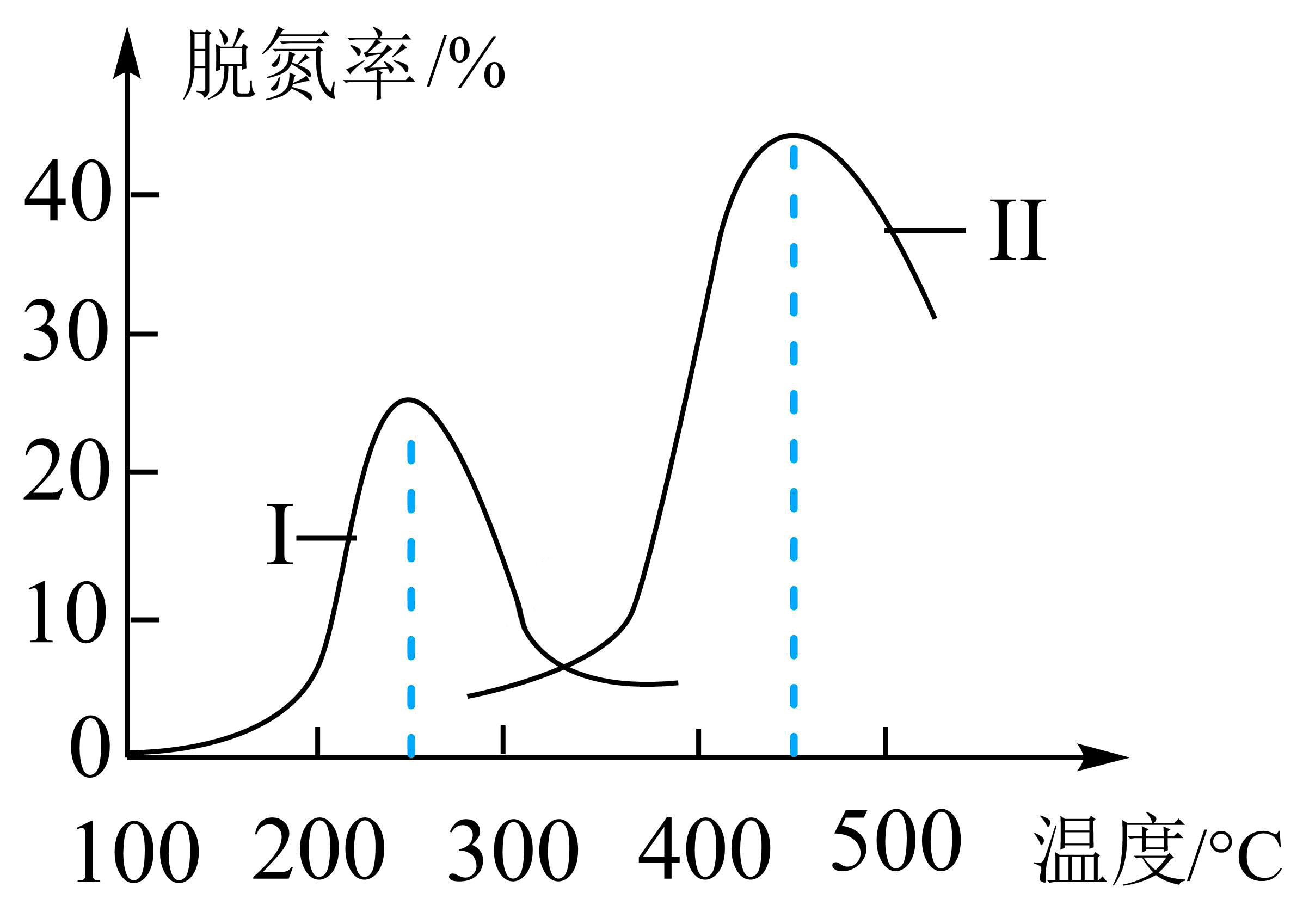
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为 。
②温度低于$\rm 200\ ^\circ \text{C}$时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是 。
催化剂$\\rm II$,$\\rm 450\\ ^\\circ \\text{C}$;温度较低时,催化剂的活性偏低
"]]由图象可知,在催化剂$\rm II$,$\rm 450\ ^\circ \text{C}$条件下达到最大脱氮率,温度较低时,催化剂的活性偏低,反应速率慢,所以脱氮率随温度升高变化不大。
在酸性溶液中,间接电化学法可对$\rm NO$进行无害化处理,其工作原理如图所示。
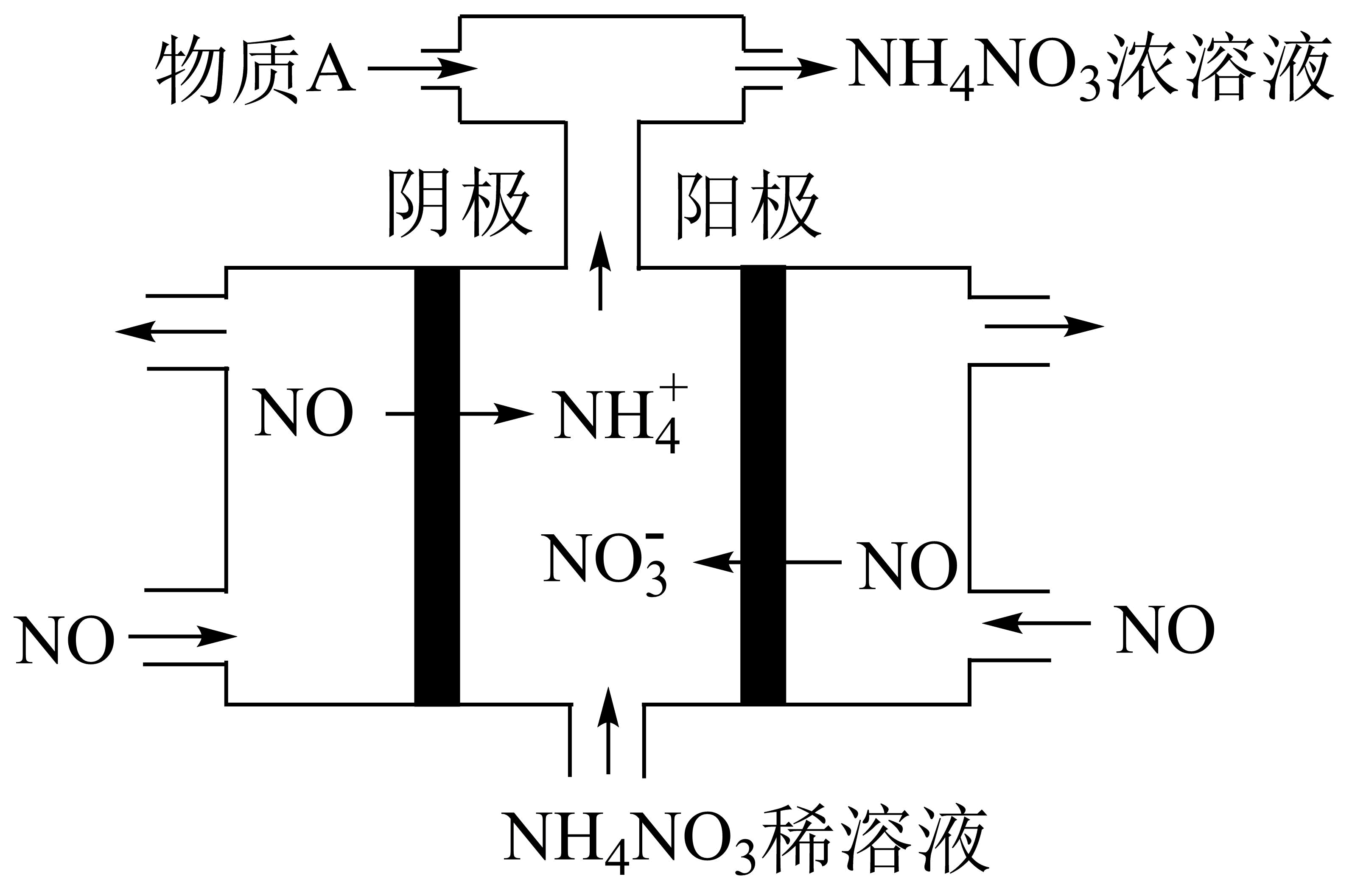
①阳极反应为: 。
②为使电解产物全部转化为$\rm NH_{4}NO_{3}$,需要补充物质$\rm A$,$\rm A$是 。
$\\rm NO-3e^{-}+2H_{2}O=NO_{3}^{-}+4H^{+}$;$\\rm NH_{3}$
"]]解$\rm NO$制备$\rm NH_{4}NO_{3}$,阳极反应为$\rm NO-3e^{-}+2H_{2}O=NO_{3}^{-}+4H^{+}$,阴极反应为:$\rm NO+5e^{-}+6H^{+}=NH_{4}^{+}+H_{2}O$,从两极反应可看出,要使得失电子守恒,阳极产生的物质的量大于阴极产生的物质的量,总反应方程式为:$\rm 8NO+7H_{2}O\begin{matrix} \underline{\underline{电解}} \\ {} \\ \end{matrix}3NH_{4}NO_{3}+2HNO_{3}$,因此若要使电解产物全部转化为$\rm NH_{4}NO_{3}$,需补充$\rm NH_{3}$。
高中 | 化学平衡常数题目答案及解析(完整版)
