高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
尿素$\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}$合成的发展体现了化学科学与技术的不断进步。
$\rm I$.二十世纪初,工业上以$\text{C}{{\text{O}}_{2}}$和$\text{N}{{\text{H}}_{3}}$为原料在一定温度和压强下合成尿素,在合成塔中存在如下转化
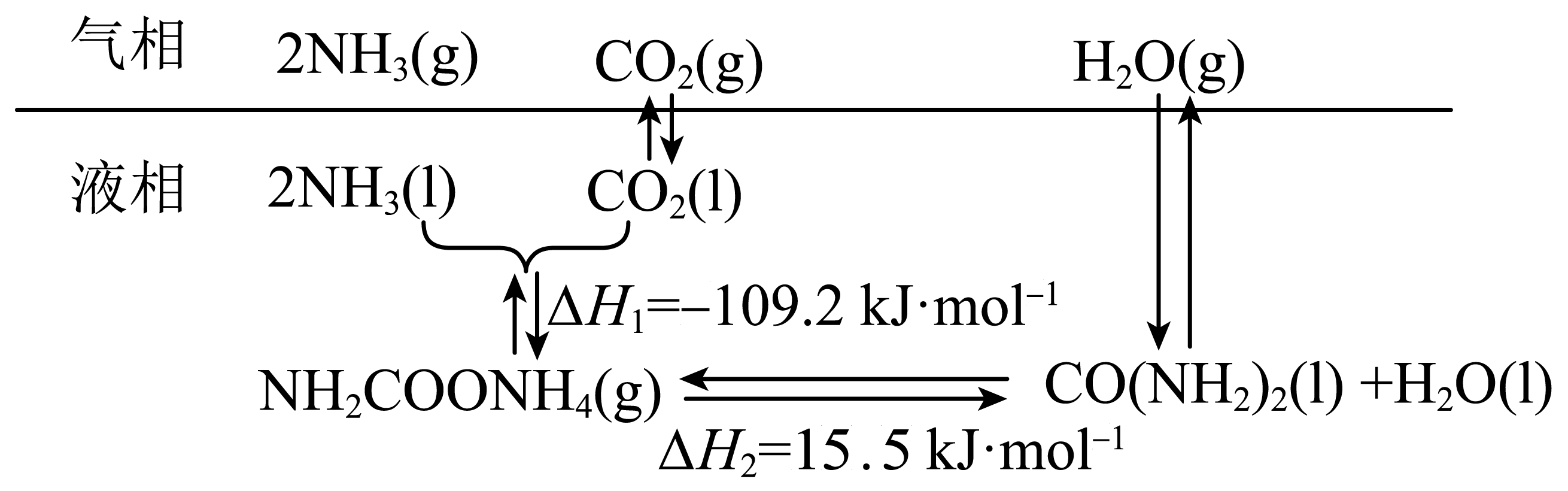
液相中,合成尿素的热化学方程式为$2\text{N}{{\text{H}}_{3}}(\text{l})+\text{C}{{\text{O}}_{2}}(\text{l})=\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}(\text{l})+{{\text{H}}_{2}}\text{O}(\text{l})\quad \Delta H=$ 。
$\\rm -93.7\\;\\rm kJ/mol$
"]]观察所给二氧化碳与氨气反应合成尿素的转化图示可知,根据盖斯定律,反应$\text{2N}{{\text{H}}_{\text{3}}}\text{(l)+C}{{\text{O}}_{\text{2}}}\text{(l)=N}{{\text{H}}_{\text{2}}}\text{COON}{{\text{H}}_{\text{4}}}\text{(g)}$,$\text{N}{{\text{H}}_{\text{2}}}\text{COON}{{\text{H}}_{\text{4}}}\text{(g)=C}{{\text{O}}_{\text{2}}}{{\text{(N}{{\text{H}}_{\text{2}}}\text{)}}_{\text{2}}}\text{(l)+}{{\text{H}}_{\text{2}}}\text{O(l)}$,两方程式相加得到$2\text{N}{{\text{H}}_{3}}(\text{l})+\text{C}{{\text{O}}_{2}}(\text{l})=\text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}(\text{l})+{{\text{H}}_{2}}\text{O}(\text{l})$,$\Delta H=\Delta {{H}_{1}}+\Delta {{H}_{2}}=-109.2\ \text{kJ/mol}+15.5\ \text{kJ/mol=-93}{.7\;\rm kJ/mol}$;
在$\rm 1\;\rm L$恒容密闭容器中,一定条件下发生反应$2\text{N}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{CO}{{\left( \text{N}{{\text{H}}_{2}} \right)}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{l})\quad \Delta H\lt 0$,下列关于该反应表述错误的是$(\quad\ \ \ \ )$。$\rm ($复选$\rm )$
低温更有利于该反应的自发进行
","增大$\\text{C}{{\\text{O}}_{2}}$浓度,可提高$\\text{N}{{\\text{H}}_{3}}$的转化率
","充入$\\rm He$,压强增大,反应速率加快,平衡向正反应方向移动
","当混合气体的平均相对分子质量不变时反应达到平衡状态
"]$\rm A$.该反应为放热且熵减,因此低温更有利于该反应的自发进行,$\rm A$正确;
$\rm B$.增大$\text{C}{{\text{O}}_{2}}$浓度,压强增大,平衡正向移动,$\text{N}{{\text{H}}_{3}}$的转化率升高,$\rm B$正确;
$\rm C$.充入$\rm He$,反应物浓度不变,平衡不移动,$\rm C$错误;
$\rm D$.该反应为反应物都是气体,生成物为固体与液体,则混合气体的平均相对分子质量一直不变,无法根据相对分子质量判断反应是否达到平衡状态,$\rm D$错误;
故选:$\rm CD$;
在上题条件下,充入$2\ \text{mol\ N}{{\text{H}}_{3}}$和$1\ \text{mol\ C}{{\text{O}}_{2}}$的原料气进行反应,$\rm 10\;\rm min$后各组分浓度不再变化,温度与反应前相同时,测得平衡体系压强变为起始的一半,该过程中$\text{N}{{\text{H}}_{3}}$的平均速率为 ,该反应的平衡常数$K$的值为 。
$0.15\\ \\text{mol/(L}\\cdot \\text{min)}$; $\\rm 2.56$
"]]在$\rm 1\;\rm L$恒容密闭容器中,充入$2\ \text{mol\ N}{{\text{H}}_{3}}$和$1\ \text{mol\ C}{{\text{O}}_{2}}$,则$\rm NH_{3}$浓度为$\rm 2\;\rm mol/L$,$\rm CO_{2}$浓度为$\rm 1\;\rm mol/L$,设二氧化碳转化量为$x$,由此列三段式:
$\begin{align} & \begin{matrix} {} & {} & {} & {} \\ \end{matrix}\text{2N}{{\text{H}}_{\text{3}}}\text{(g)+C}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{CO}{{\left( \text{N}{{\text{H}}_{\text{2}}} \right)}_{\text{2}}}\text{(s)+}{{\text{H}}_{\text{2}}}\text{O(l)} \\ & \begin{matrix} 起始\left( \text{mol/L} \right) & \text{2} & {} \\转化 \left( \text{mol/L} \right) & {2x} & {} \\平衡 \left( \text{mol/L} \right) & {2-x} & {} \\ \end{matrix}\begin{matrix} {} & \text{1} & {} \\ {} & {x} & {} \\ {} & {1-x} & {} \\ \end{matrix}\begin{matrix} {} & {} & {} \\ {} & {} & {} \\ {} & {} & {} \\ \end{matrix}\begin{matrix} {} & {} & {} \\ {} & {} & {} \\ {} & {} & {} \\ \end{matrix} \\ \end{align}$
由题意可列:$\dfrac{2-x+1-x}{2+1}=\dfrac{1}{2}$,解得$ x=0.75$;则氨气的平均反应速率为$v=\dfrac{\text{0}{.75\;\rm mol/L}\times \text{2}}{10\;\rm \min }=0.15\ \text{mol/(L}\cdot \text{min)}$;平衡常数$K=\dfrac{1}{{c}\left( \text{C}{{\text{O}}_{2}} \right){c}\left( \text{N}{{\text{H}}_{3}} \right)}=\dfrac{1}{0.25\times {{\left( 1.25 \right)}^{2}}}=2.56$。
高中 | 化学平衡常数题目答案及解析(完整版)
