高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
研究$\rm NO_{2}$、$\rm NO$、$\rm SO_{2}$ 、$\rm CO$等大气污染气体的处理具有重要意义,有关研究表明氨气在处理大气污染中有一定的作用。
Ⅰ$\rm .$ 利用反应$\rm 6NO_{2}(g)+8NH_{3}(g) \overset{催化剂 }{\underset{加热 }{\rightleftharpoons}} 7N_{2}(g)+12H_{2}O(g)$可处理$\rm NO_{2}$
在$\rm 2\;\rm L$的密闭容器中,$2$分钟内上述反应混合物的物质的量增加了$\rm 0.25\;\rm mol$,则$2$分钟内$ v\rm (NH_{3})=$ 。
$\\rm 0.1\\;\\rm mol·L^{-1}·min^{-1}$
"]]根据反应$\rm 6NO_{2}(g)+8NH_{3}(g) \overset{催化剂 }{\underset{加热 }{\rightleftharpoons}} 7N_{2}(g)+12H_{2}O(g)$可知,按照计量数反应,反应前后总物质的量增加了$\rm 5\;\rm mol$,则$2$分钟内上述反应混合物的物质的量增加了$\rm 0.25\;\rm mol$时,消耗的$\dfrac{8\;\rm mol}{ {n}\left(\rm N{{H}_{3}} \right)}=\dfrac{5\;\rm mol}{0.25\;\rm mol}\Rightarrow {n}\left(\rm N{{H}_{3}} \right)=0.4\;\rm mol$,所以$v\left(\rm N{{H}_{3}} \right)=\dfrac{\dfrac{0.4\;\rm mol}{2\text{ L}}}{2\;\rm \min }=0.1\;\rm mol\cdot {{\text{L}}^{-1}}\cdot {{\min }^{-1}}$。
写出该反应的化学平衡常数表达式 ;已知该反应平衡常数$(K)$与温度$(T)$的关系如图所示, 若升高温度,则$v_{正}$ $v_{逆}($填“大于”、“小于”或“等于”$)$;反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均分子量将 $\rm ($填“变大”、“变小”或“不变”$\rm )$。
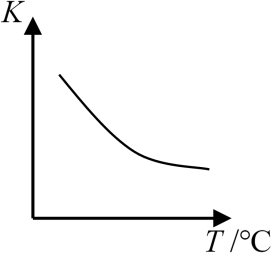
${K=}\\dfrac{{{{c}}^{{12}}}{(}{{\\rm {H}}_{{2}}}{\\rm O)}{{{c}}^{{7}}}{(}{{\\rm {N}}_{{2}}}{)}}{{{{c}}^{{8}}}{\\rm (N}{{\\rm {H}}_{{3}}}{)}{{{c}}^{{6}}}{\\rm (N}{{\\rm {O}}_{{2}}}{)}}$;小于;变大
"]]根据反应$\rm 6NO_{2}(g)+8NH_{3}(g) \overset{催化剂 }{\underset{加热 }{\rightleftharpoons}} 7N_{2}(g)+12H_{2}O(g)$可处理$\rm NO_{2}$可知,该反应的化学平衡常数${K}=\dfrac{{{{c}}^{7}}\left( \rm {{{N}}_{2}} \right){{{c}}^{12}}\left(\rm {{{H}}_{2}}{O} \right)}{{{{c}}^{6}}\left(\rm N{{O}_{2}} \right){{{c}}^{8}}\left(\rm N{{H}_{3}} \right)}$;根据平衡常数$(K)$与温度$(T)$的关系图形,升高温度,$K$减小,说明平衡向逆反应方向移动,则${{{ }v}_正{}}\lt {{v{ }}_逆{}}$;反应达到平衡后若缩小反应容器体积,其它条件不变,等于增大压强,平衡向逆反应方向移动,气体的物质的量减小,总质量不变,由${M}=\dfrac{{m}}{{n}}$得出混合气体的平均分子量变大。
Ⅱ$\rm .$ 用尿素$\rm CO(NH_{2})_{2}$水解生成的$\rm NH_{3}$催化还原$\rm NO$是柴油机车辆尾气净化的主要方法。$\rm 4NH_{3}(g)+O_{2}(g)+4NO(g ⇌ 4N_{2}(g)+6H_{2}O(g)$
上述反应的$\Delta S$ $\rm 0($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。
$\\rm \\gt $
"]]根据$\rm 4NH_{3}(g)+O_{2}(g)+4NO(g ⇌ 4N_{2}(g)+6H_{2}O(g)$,是一个体积增大的反应,则反应的$\Delta {S}\gt 0$。
尿素在$\rm 140-160\;\rm ^\circ\rm C$时平均水解产氨率可以达到$\rm 98.73\%$,写出其水解反应方程式 。
$\\rm CO{{\\left( N{{H}_{2}} \\right)}_{2}}+{{\\text{H}}_{2}}\\text{O}\\begin{array}{*{20}{c}}{\\underline{\\underline {140{}\\;^\\circ \\text{C}\\sim160{}\\;^\\circ \\text{C}}} }\\\\{}\\end{array}2N{{H}_{3}}\\uparrow +C{{O}_{2}}\\uparrow $
"]]尿素水解产生氨气,同时还二氧化碳生成,水解方程式为:$\rm CO{{\left( N{{H}_{2}} \right)}_{2}}+{{\text{H}}_{2}}\text{O}\begin{array}{*{20}{c}}{\underline{\underline {140{}\;^\circ \text{C}\sim160{}\;^\circ \text{C}}} }\\{}\end{array}2N{{H}_{3}}\uparrow +C{{O}_{2}}\uparrow $。
实际应用中,并非加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小,其原因是 。
$\\rm NO$反应消耗完后,剩余的$\\rm NH_{3}$排入大气会造成污染
"]]尿素水解产生氨气,当$\rm NO$被消耗完后,多余的氨气排放在空气中,也会造成大气污染。
除了利用尿素水解生成氨气,工业制备氨气主要是以氮气、氢气作为原料合成。在下列合成氨的事实中,不能用勒夏特列原理来解释的是$\rm (\quad\ \ \ \ )$。
①使用铁催化剂有利于合成氨反应
②在$\rm 500\;\rm ^\circ\rm C$左右高温下反应比常温下更有利于合成氨
③增大体系的压强,可以提高混合物中氨的百分含量
④在合成氨生产中,要不断补充新鲜的高压氮、氢混合气
①③
","②④
","①②
","③④
"]合成氨的事实中,不能用勒夏特列原理来解释的是
①使用铁催化剂有利于合成氨反应:催化剂不改变平衡的移动,不能用勒夏特列原理来解释,①符合题意;
②在$\rm 500\;\rm ^\circ\rm C$左右高温下反应比常温下更有利于合成氨:合成氨为放热反应,升温平衡向左移动,氨气的含量减小,不利于合成氨,不能用勒夏特列原理来解释,②符合题意;
③增大体系的压强,可以提高混合物中氨的百分含量:增大压强,平衡向右移动,有利于合成氨,能用勒夏特列原理来解释,③不符合题意;
④在合成氨生产中,要不断补充新鲜的高压氮、氢混合气:不停增大反应物浓度,使平衡向右移动,有利于合成氨,能用勒夏特列原理来解释,④不符合题意。
符合题意的为:①②。
碳铵分解也可获得氨气。一定温度下,将一定量$\rm NH_{4}HCO_{3}$投入一个密闭容器中发生如下反应:$\rm NH_{4}HCO_{3}(s) ⇌ NH_{3}(g)+CO_{2}(g)+H_{2}O(g)$,达到平衡后${\rm [CO_{2}]}=x\;\rm mol·L^{-1}$,缩小容器体积,经过一段时间反应再次平衡时${\rm [CO_{2}]}=y\;\rm mol·L^{-1}$,下列有关$x$和$y$的关系判断正确的是$(\quad\ \ \ \ )$。
$x\\gt y$
","$x=y$
","$x\\lt y$
","题中所给条件不足以判断
"]根据反应:$\rm NH_{4}HCO_{3}(s) ⇌ NH_{3}(g)+CO_{2}(g)+H_{2}O(g)$,当达到平衡后${\rm [CO_{2}]}=x\;\rm mol·L^{-1}$时,缩小容器体积,等于增大压强,平衡向左移动,经过一段时间反应再次平衡时${\rm [CO_{2}]}=y\;\rm mol·L^{-1}$,温度不变,因为反应物为固体,平衡常数等于生成物浓度的乘积且不变,要保证平衡常数不变,则平衡时生成物各物质的量浓度也不能变,即$x=y$。
Ⅲ$\rm .$ 温度达到$\rm 183.5\;\rm ^\circ\rm C$时,可以利用催化剂将$\rm NH_{3}$分解为$\rm N_{2}$和$\rm H_{2}$。
已知该反应的$\Delta S=198.9\;\rm J·mol^{-1}·K^{-1}$,则该反应的$\Delta H=$ $\rm ($保留$\rm 1$位小数$\rm )$。
$+90.8\\;\\rm kJ\\cdot mo{{l}^{-1}}$
"]]温度达到$\rm 183.5\;\rm ^\circ\rm C$时,可以利用催化剂将$\rm NH_{3}$分解为$\rm N_{2}$和$\rm H_{2}$,已知该反应的$\Delta S=198.9\;\rm J·mol^{-1}·K^{-1}$,根据自由能$\Delta {G}\leqslant 0$时反应能自发进行,当温度达到$\rm 183.5\;\rm ^\circ\rm C$时,刚好促使反应进行,则$\Delta {G}=0$,由$\Delta {G}=\Delta {H}-{T}\cdot \Delta {S}=0\Rightarrow \Delta {H}={T}\cdot \Delta {S}$,则该反应的反应热$\Delta {H}={T}\cdot \Delta {S}=\rm\left( 183.5\;{}^\circ {C}+273\;{K}\cdot {}^\circ {{{C}}^{-1}} \right)\cdot 198.9\;{J}\cdot mo{{l}^{-1}}\cdot {{{K}}^{-1}}=+90797.85\;{J}\cdot mo{{l}^{-1}}=+90.8\;\rm kJ\cdot mo{{l}^{-1}}$。
高中 | 化学平衡常数题目答案及解析(完整版)
