高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
甲烷燃料电池采用铂做电极材料,两个电极上分别通入$\rm C{{H}_{4}}$和$\rm {{O}_{2}}$,电解质溶液为$\rm KOH$溶液。某研究小组将上述甲烷燃料电池作为电源,进行电解饱和食盐水和电镀的实验,如图所示,其中乙装置中$\rm X$为离子交换膜。下列说法正确的是$(\quad\ \ \ \ )$
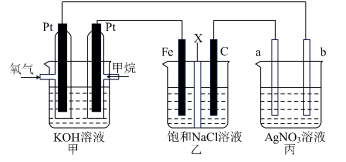
甲烷燃料电池正极电极反应式是$\\rm {{O}_{2}}+4{{e}^{-}}+4{{H}^{+}}=2{{H}_{2}}O$
","为了防止生成的氯气和氢氧化钠接触,乙中为阴离子交换膜
","丙中的$\\rm AgN{{O}_{3}}$溶液,银离子浓度减小
","乙中上一共产生气体$\\rm 2.24\\ L$$\\rm ($标准状况$\\rm )$时,$\\rm a$极质量增加$\\rm 10.8\\ g$
"]$\rm A$.甲烷燃料电池,碱性环境下,正极电极反应式是$\rm {{O}_{2}}+4{{e}^{-}}+2{{H}_{2}}O=4O{{H}^{-}}$,故$\rm A$错误;
$\rm B$.乙装置中,$\rm Fe$铁电极为阴极,水中的氢离子得电子生成氢气,余下氢氧根离子,石墨电极为阳极,氯离子失电子生成氯气,则乙中$\rm X$为阳离子交换膜,$\rm Na^{+}$移动向阴极,阴极得到$\rm NaOH$和氢气,为了防止生成的氯气和氢氧化钠接触,乙中为阳离子交换膜,故$\rm B$错误;
$\rm C$.丙装置中,若为$\rm AgNO_{3}$溶液,电镀时,$\rm a$电极为阴极,银离子得电子生成银,$\rm b$电极为阳极,银失电子生成阴离子,溶液银离子浓度不变,故$\rm C$错误;
$\rm D$.乙中上一共产生气体$\rm 2.24\;\rm L($标准状况$\rm )$时,其物质的量为$\rm 0.1\;\rm mol$时,各产生$\rm 0.05\;\rm mol$的氢气和氯气,则电路中转移$\rm 0.1\;\rm mol$电子,则$\rm a$极析出$\rm 0.1\;\rm mol$银单质,其质量增加$\rm 10.8\;\rm g$,故$\rm D$正确。
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
