高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
我国科学家开发了一种自充电水系$\rm Zn-NaFe\left[ Fe{{(CN)}_{6}} \right]$电池,电池电能耗尽后,无需外接电源,可通过$\rm {{H}_{2}}{{O}_{2}}$实现电池自充电,电池工作原理如图。下列说法错误的是$\rm (\qquad)$
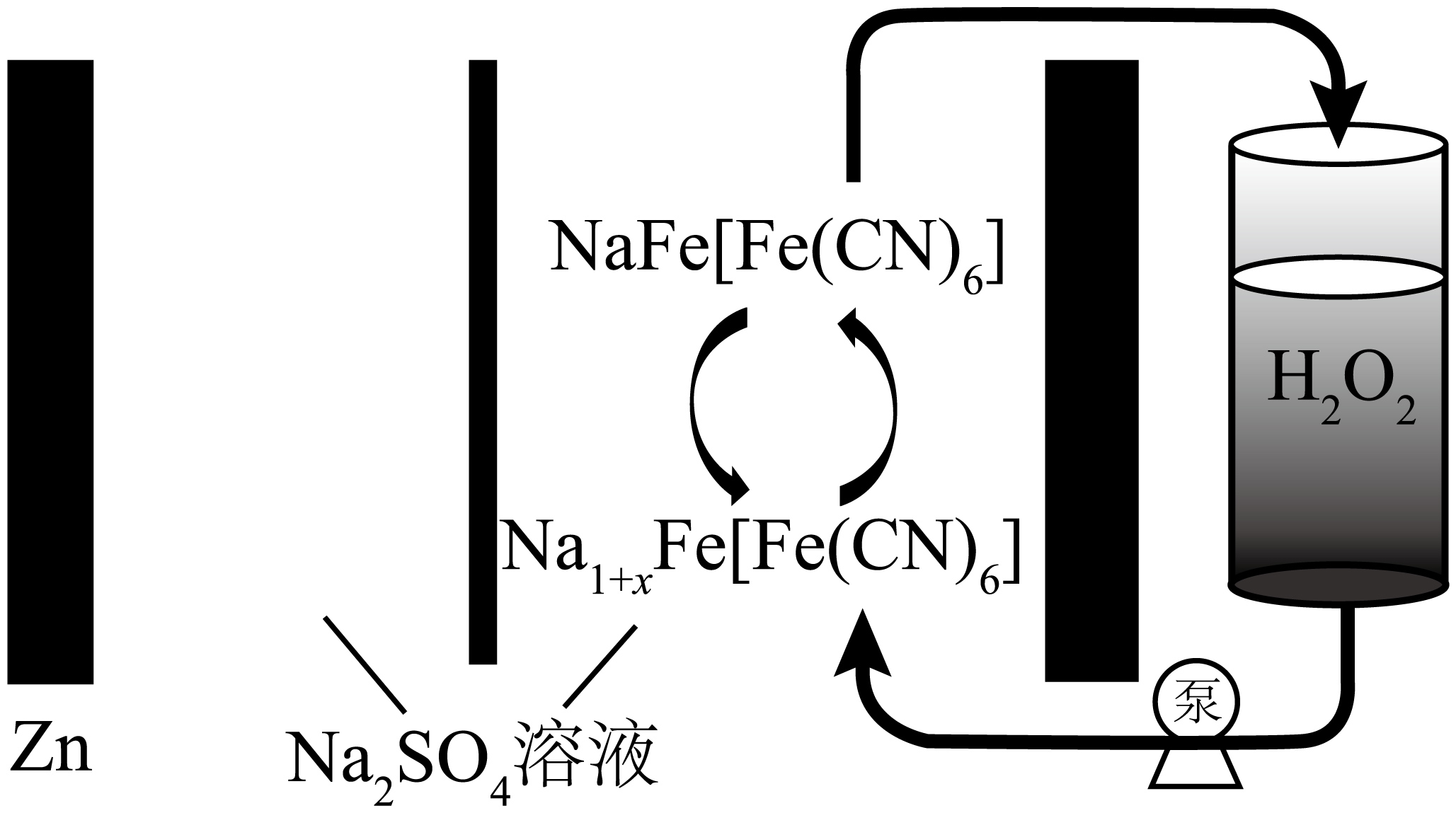
该电池装置负极材料需足量
","放电时,$\\rm SO_{4}^{2-}$向$\\rm Zn$电极移动
","放电时,右侧电极反应为:${\\rm NaFe\\left[ Fe{{(CN)}_{6}} \\right]}+x{{\\rm e}^{-}}+x{\\rm N}{{\\rm a}^{+}}={\\rm N}{{\\rm a}_{1+x}}\\rm Fe\\left[ Fe{{(CN)}_{6}} \\right]$
","自充电时,每消耗$\\rm 1\\ mol\\ {{H}_{2}}{{O}_{2}}$,溶液中增加$2x\\ \\rm mol\\ N{{a}^{+}}$
"]放电时,负极为$\rm Zn→Zn^{2+}$,正极为${\rm NaFe[Fe(CN)_{6}]→Na}_{1+x}\rm Fe[Fe(CN)_{6}]$;自充电时$\rm H_{2}O_{2}$为氧化剂,将${\rm Na}_{1+x}\rm Fe[Fe(CN)_{6}]$氧化恢复为$\rm NaFe[Fe(CN)_{6}]$,据此解答:
$\rm A$.该电池的负极材料$\rm Zn$在放电时会溶解,而自充电时不能再生,因此需足量负极材料,故$\rm A$正确。
$\rm B$.放电时,$\rm Zn$为负极,发生反应$\rm Zn-2e^{-}=Zn^{2+}$,附近阳离子浓度增加,因此$\rm SO_{4}^{2-}$向$\rm Zn$电极移动保持溶液电中性,故$\rm B$正确。
$\rm C$.放电时,正极为$\rm NaFe[Fe(CN)_{6}]$与$\rm Na^{+}$结合得电子形成${\rm Na}_{1+x}\rm Fe[Fe(CN)_{6}]$,电极方程式为${\rm NaFe\left[ Fe{{(CN)}_{6}} \right]}+x{{\rm e}^{-}}+x{\rm N}{{\rm a}^{+}}={\rm N}{{\rm a}_{1+x}}\rm Fe\left[ Fe{{(CN)}_{6}} \right]$,故$\rm C$正确。
$\rm D$.自充电时,右侧电极反应为${\rm N}{{\rm a}_{1+x}}{\rm Fe\left[ Fe{{(CN)}_{6}} \right]}-x{{\rm e}^{-}}={\rm NaFe\left[ Fe{{(CN)}_{6}} \right]}+x\rm N{{a}^{+}}$,溶液中增加$x\ \rm mol\ Na^{+}$转移$x\ \rm mol$电子,$\rm 1\ mol$过氧化氢被还原为水转移$\rm 2\ mol$电子,因此每消耗$\rm 1\ mol\ {{H}_{2}}{{O}_{2}}$,溶液中增加$\rm 2\ mol\ N{{a}^{+}}$,故$\rm D$错误。
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
