高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
清华大学尹斓副教授、熊巍博士提出了一种可完全生物降解的锌$\rm -$钼$\rm (\text{Zn-Mo}\rm )$原电池,是实现生物可吸收电子药物的重要电源,结构如图所示。已知电池使用过程中在$\text{Zn}$表面形成一层$\text{ZnO}$薄膜,下列说法正确的是$(\quad\ \ \ \ )$
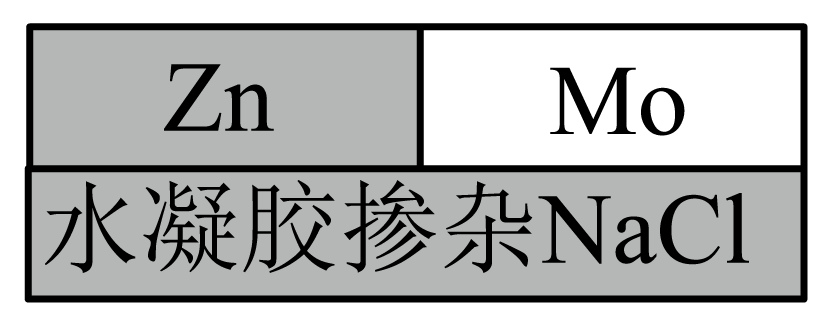
$\\text{Zn}$作原电池负极,其质量逐渐减小
","该电池在放电过程中,水凝胶的$\\text{pH}$不变
","$\\text{Zn}$表面发生的电极反应:$\\text{Zn}-2{{\\text{e}}^{-}}=\\text{Z}{{\\text{n}}^{2+}}$
","电路中转移$0.02\\ \\text{mol}$电子时,理论上消耗$0.02\\ \\text{mol }{{\\text{O}}_{2}}$
"]锌为活泼金属,失去电子发生氧化反应,是负极,电极反应式为$\text{Zn-2}{{\text{e}}^{-}}+{{\text{H}}_{\text{2}}}\text{O=ZnO+2}{{\text{H}}^{+}}$,$\rm Mo$为正极,电极反应式为${{\text{O}}_{\text{2}}}\text{+4}{{\text{e}}^{-}}\text{+2}{{\text{H}}_{\text{2}}}\text{O=4O}{{\text{H}}^{-}}$。
$\rm A$.$\rm Zn$为原电池负极发生氧化还原反应生成$\rm ZnO$,电极质量增大,$\rm A$错误;
$\rm B$.负极反应式为$\text{Zn-2}{{\text{e}}^{-}}+{{\text{H}}_{\text{2}}}\text{O=ZnO+2}{{\text{H}}^{+}}$,正极电极反应式为${{\text{O}}_{\text{2}}}\text{+4}{{\text{e}}^{-}}\text{+2}{{\text{H}}_{\text{2}}}\text{O=4O}{{\text{H}}^{-}}$,则总反应式为:$\text{2Zn+}{{\text{O}}_{\text{2}}}\text{=2ZnO}$,水凝胶的$\text{pH}$不变,故$\rm B$正确;
$\rm C$.锌失去电子发生氧化反应,电极反应式为$\text{Zn-2}{{\text{e}}^{-}}+{{\text{H}}_{\text{2}}}\text{O=ZnO+2}{{\text{H}}^{+}}$,$\rm C$错误;
$\rm D$.正极电极反应式为${{\text{O}}_{\text{2}}}\text{+4}{{\text{e}}^{-}}\text{+2}{{\text{H}}_{\text{2}}}\text{O=4O}{{\text{H}}^{-}}$,电路中转移$0.02\ \text{mol}$电子时,理论上消耗$\text{0}\text{.005}\ \text{mol }{{\text{O}}_{\text{2}}}$,则$\rm D$错误;
故选:$\rm B$
高中 | 原电池工作原理题目答案及解析(完整版)
