高中 | 离子方程式 题目答案及解析
稿件来源:高途
高中 | 离子方程式题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
离子方程式
往$\rm 10\;\rm mL\;\rm 0.2\;\rm mol/L$的氢氧化钠溶液中加入$\rm 10\;\rm mL\;\rm 0.01\;\rm mol/L$的硫酸,如图$\rm 1$所示,发现没有明显的现象。分别取烧杯$\rm B$中溶液进行以下实验,结果如图$\rm 2$所示。以下说法错误的是$\rm (\qquad)$
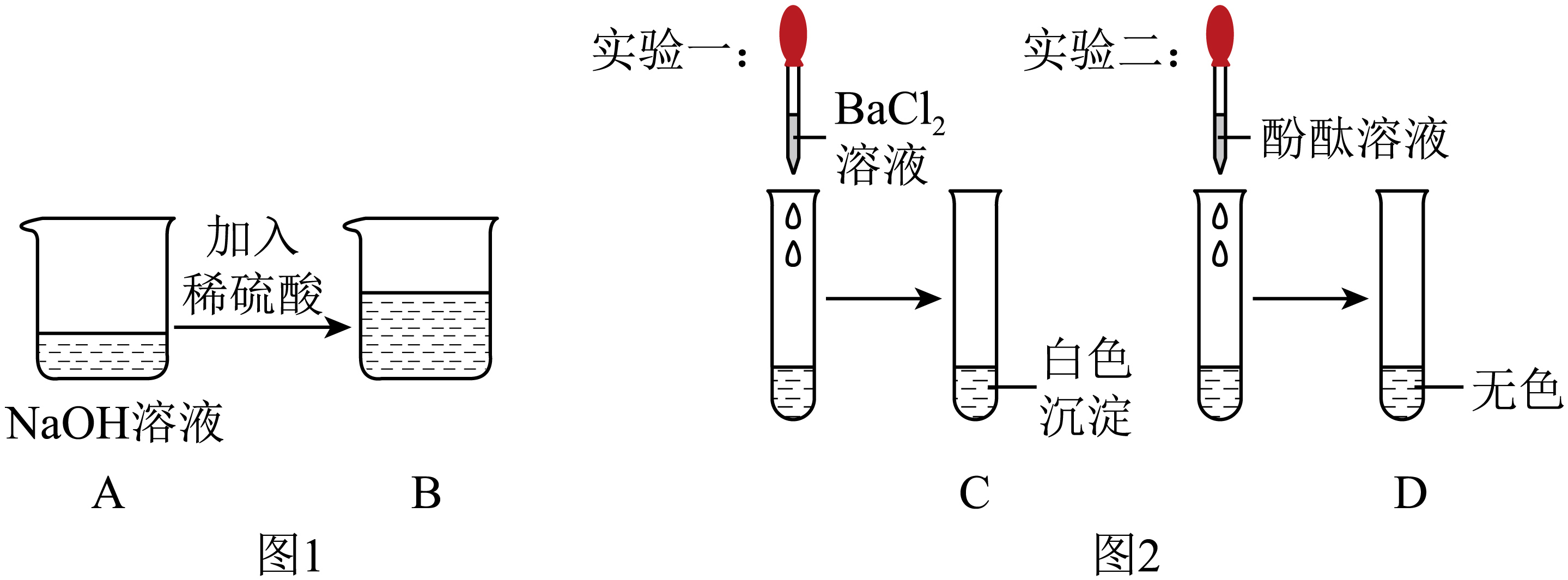
实验一的目的是为了检验溶液中是否有$\\rm SO_{4}^{2−}$
","$\\rm D$中溶液为无色,说明溶液中没有$\\rm H_{2}SO_{4}$
","将试管$\\rm C$静置,上层清液中一定含有$\\rm NaCl$
","$\\rm B$中发生的反应为:$\\rm H^{+} + OH^{−} = H_{2}O$
"]$\rm A$.$\rm SO_{4}^{2−}$可以与钡离子生成硫酸钡沉淀,因此实验一的目的是为了检验溶液中是否有$\rm SO_{4}^{2−}$,$\rm A$正确;
$\rm B$.酚酞遇到酸性溶液不变色,遇到碱性溶液变红,$\rm D$中溶液为无色,硫酸可能过量,不能说明溶液中没有$\rm H_{2}SO_{4}$,$\rm B$错误;
$\rm C$.根据反应$\rm 2NaOH+H_{2}SO_{4}=Na_{2}SO_{4}+2H_{2}O$,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,因此将试管$\rm C$静置,上层清液中一定含有的溶质是$\rm NaCl$,$\rm C$正确;
$\rm D$.根据反应$\rm 2NaOH+H_{2}SO_{4}=Na_{2}SO_{4}+2H_{2}O$,离子方程式为:$\rm H^{+} + OH^{−} = H_{2}O$,$\rm D$正确;
故选:$\rm B$。
高中 | 离子方程式题目答案及解析(完整版)
