高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
一种应用比较广泛的乙醇燃料电池,电解液是酸性溶液,其工作原理如图所示,下列说法不正确的是$(\qquad)$
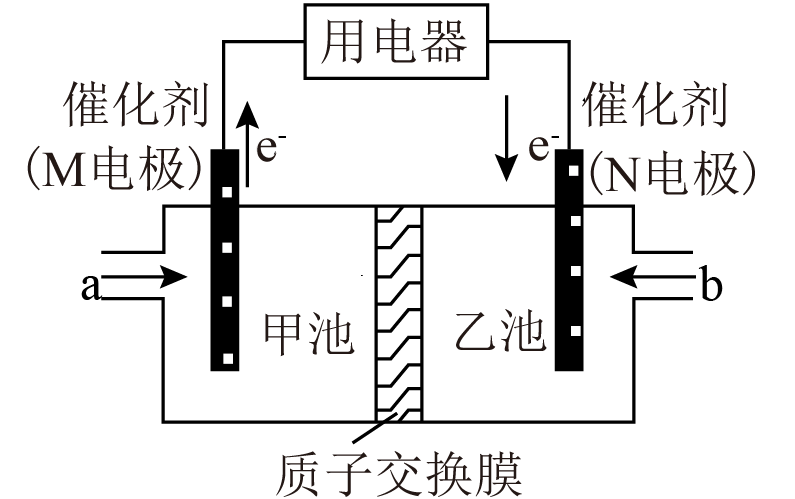
$\\rm M$极为负极,发生氧化反应
","$\\rm N$极电极反应为$\\rm {{\\text{O}}_{\\text{2}}} +4 {{\\text{e}}^{-}} +2 {{\\text{H}}_{\\text{2}}} {O=4O}{{\\text{H}}^{-}}$
","甲池溶液$\\rm pH$减小
","若有$\\text{1\\;\\rm mol\\;\\rm C}{{\\text{O}}_{\\text{2}}}$生成,则有$\\text{6\\;\\rm mol}{{\\text{ H}}^{+}}$从甲池通过交换膜进入乙池
"]由电子流向可知,通入乙醇的$\rm M$电极为燃料电池的负极,水分子作用下乙醇在负极失去电子发生氧化反应生成二氧化碳和氢离子,电极反应式为$\rm CH_{3}CH_{2}OH-12e^{-}+3H_{2}O =2CO_{2}+12H^{+}$,通入氧气的$\rm N$电极为正极,酸性条件下氧气在正极得到电子发生还原反应生成水,电极反应式为$\rm 4H^{+}+O_{2}+4e^{-}=2H_{2}O$。
$\rm A$.由分析可知,通入乙醇的$\rm M$电极为燃料电池的负极,水分子作用下乙醇在负极失去电子发生氧化反应生成二氧化碳和氢离子,故$\rm A$正确;
$\rm B$.由分析可知,通入氧气的$\rm N$电极为正极,酸性条件下氧气在正极得到电子发生还原反应生成水,电极反应式为$\rm 4H^{+}+O_{2}+4e^{-}=2H_{2}O$,故$\rm B$错误;
$\rm C$.由分析可知,通入乙醇的$\rm M$电极为燃料电池的负极,水分子作用下乙醇在负极失去电子发生氧化反应生成二氧化碳和氢离子,电极反应式为$\rm CH_{3}CH_{2}OH-12e^{-}+3H_{2}O =2CO_{2}+12H^{+}$,则甲池溶液$\rm pH$减小,故$\rm C$正确;
$\rm D$.由分析可知,通入乙醇的$\rm M$电极为燃料电池的负极,水分子作用下乙醇在负极失去电子发生氧化反应生成二氧化碳和氢离子,电极反应式为$\rm CH_{3}CH_{2}OH-12e^{-}+3H_{2}O =2CO_{2}+12H^{+}$,则有$\text{1\;\rm mol\;\rm C}{{\text{O}}_{\text{2}}}$生成时,有$\text{6\;\rm mol}{{\text{ H}}^{+}}$从甲池通过交换膜进入乙池,故$\rm D$正确。
故选:$\rm B$
高中 | 原电池工作原理题目答案及解析(完整版)
