高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
钒液流电池具有广泛的应用领域和市场前景,电池放电时的部分工作原理如图所示。
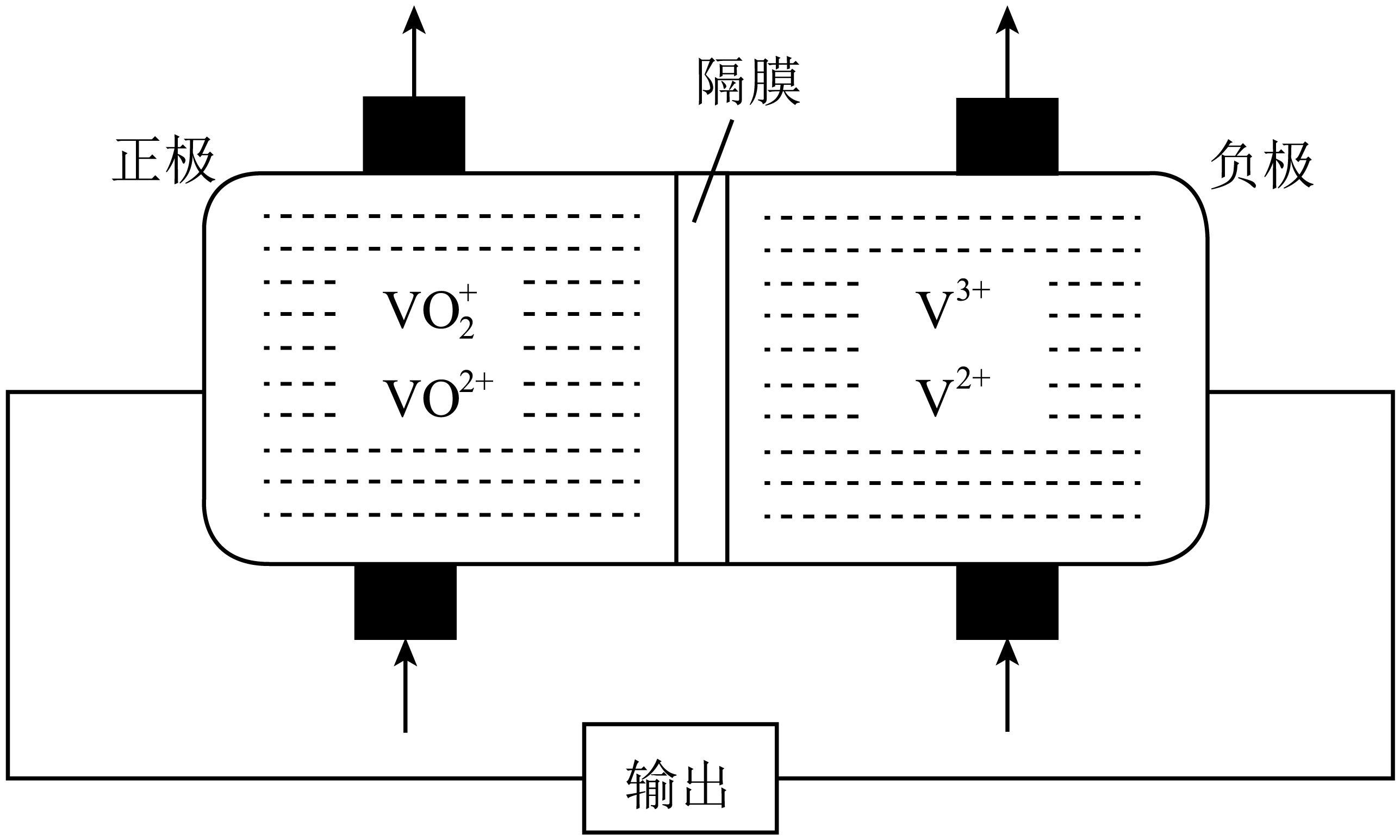
下列相关叙述错误的是$(\quad\ \ \ \ )$
电池放电时,$\\rm H^{+}$是从左侧移向右侧
","溶液的$\\rm pH$值会影响电池的放电效率
","电池充电时,左侧是阳极,右侧是阴极
","电池充电时,阳极发生氧化反应,电极反应式是:$\\text{V}{{\\text{O}}^{2+}}-{{\\text{e}}^{-}}+{{\\text{H}}_{2}}\\text{O}=\\text{VO}_{2}^{+}+2{{\\text{H}}^{+}}$
"]由装置图可知放电时右侧作负极,电极发生的反应为:${{\text{V}}^{\text{2}}}^{+}-{{\text{e}}^{-}}={{\text{V}}^{\text{3+}}}$,左侧作正极电极发生反应:$\text{VO}_{2}^{+}+{{\text{e}}^{-}}\text{+2}{{\text{H}}^{+}}=\text{V}{{\text{O}}^{\text{2+}}}+{{\text{H}}_{\text{2}}}\text{O}$。
$\rm A$.电池放电时,阳离子向正极移动 ,则$\rm H^{+}$是从右侧移向左侧,$\rm A$错误;
$\rm B$.电池的正极反应,需要氢离子,溶液的$\rm pH$值会影响电池的放电效率,$\rm B$正确;
$\rm C$.充电时,左侧是阳极,电极反应为:$\text{V}{{\text{O}}^{2+}}-{{\text{e}}^{-}}+{{\text{H}}_{2}}\text{O}=\text{VO}_{2}^{+}+2{{\text{H}}^{+}}$,右侧是阴极,电极反应为${{\text{V}}^{\text{3+}}}+{{\text{e}}^{-}}={{\text{V}}^{\text{2}}}^{+}$,$\rm C$正确;
$\rm D$.电池充电时,阳极发生氧化反应,电极反应式是:$\text{V}{{\text{O}}^{2+}}-{{\text{e}}^{-}}+{{\text{H}}_{2}}\text{O}=\text{VO}_{2}^{+}+2{{\text{H}}^{+}}$,$\rm D$正确;
故选:$\rm A$
高中 | 原电池工作原理题目答案及解析(完整版)
