高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
南开大学陈军团队成功研发出一种以两性羟基乙酸铝$\left[ \text{AlAc}{{(\text{OH})}_{2}}{{\left( {{\text{H}}_{2}}\text{O} \right)}_{3}} \right]$为电解质的二次电池。两性羟基乙酸铝具有${{\text{H}}^{+}}$和$\text{O}{{\text{H}}^{-}}$双极电离能力,该电池充电时的原理如下图所示,下列说法错误的是$(\quad\ \ \ \ )$
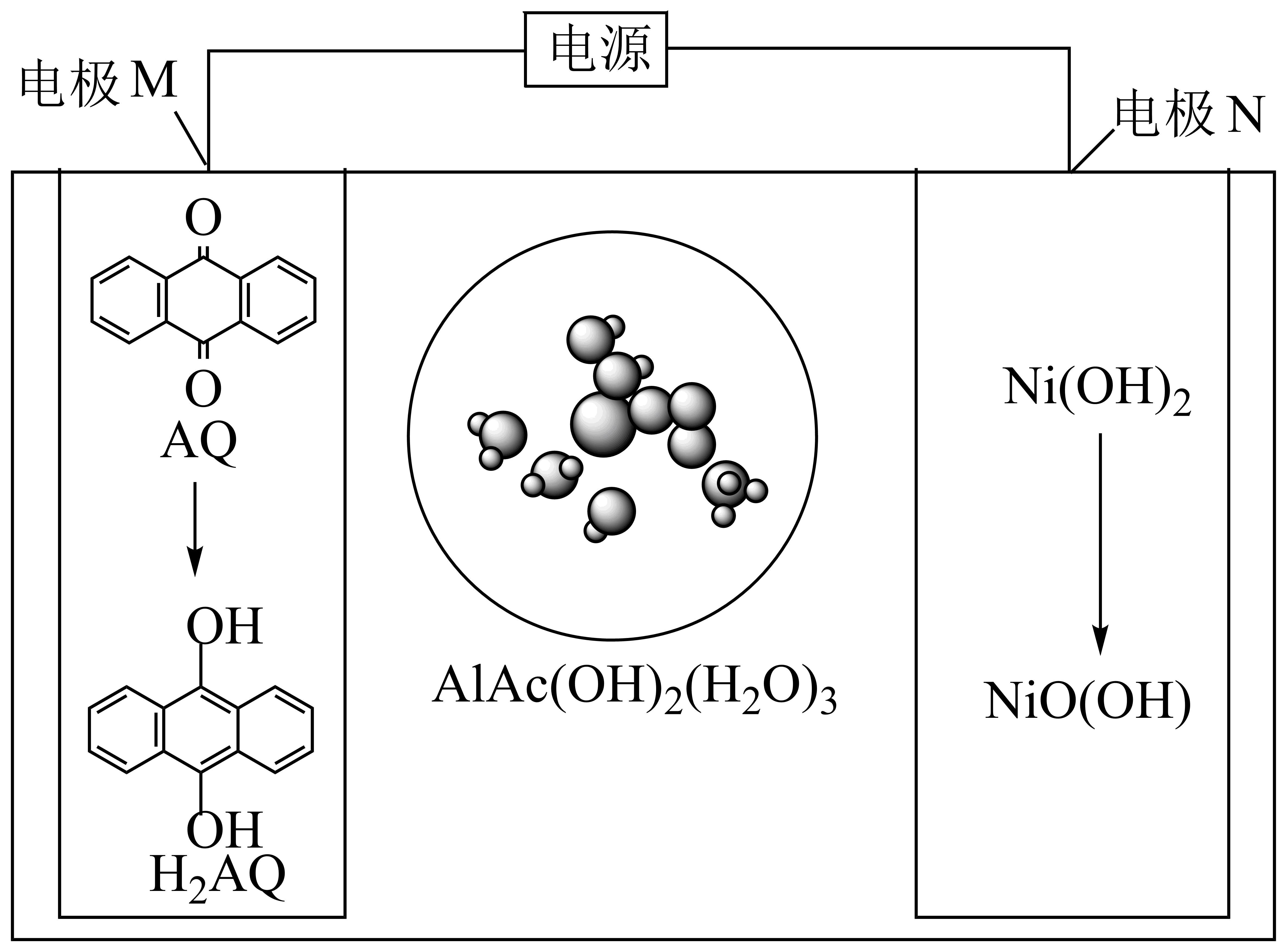
放电时,$\\rm N$极发生还原反应
","放电时,负极的电极方程式为:${{\\text{H}}_{2}}\\text{AQ}-2{{\\text{e}}^{-}}=\\text{AQ}+2{{\\text{H}}^{+}}$
","充电时,电极$\\rm M$连接电源负极
","充电时,当两性羟基乙酸铝电离出$2\\text{ mol }{{\\text{H}}^{+}}$时,阳极板质量增加$\\rm 2$ $\\rm g$
"]分析:由图可知,充电时,与直流电源负极相连的电极$\rm M$为阴极,酸性条件下$\rm AQ$在阴极得到电子发生还原反应生成$\rm H_{2}AQ$,电极$\rm N$为阳极,碱性条件下氢氧化镍在阳极失去电子发生氧化反应生成碱式氧化镍和水;则放电时,电极$\rm M$为原电池的负极,$\rm H_{2}AQ$在负极失去电子发生氧化反应生成$\rm AQ$和氢离子,电极$\rm N$为正极,水分子作用碱式氧化镍在正极得到电子发生还原反应生成氢氧化镍和氢氧根离子。
$\rm A$.由分析可知,放电时,电极$\rm N$为正极,水分子作用碱式氧化镍在正极得到电子发生还原反应生成氢氧化镍和氢氧根离子,故$\rm A$正确;
$\rm B$.由分析可知,放电时,电极$\rm M$为原电池的负极,$\rm H_{2}AQ$在负极失去电子发生氧化反应生成$\rm AQ$和氢离子,电极反应式为${{\text{H}}_{2}}\text{AQ}-2{{\text{e}}^{-}}=\text{AQ}+2{{\text{H}}^{+}}$,故$\rm B$正确;
$\rm C$.由分析可知,充电时,与直流电源负极相连的电极$\rm M$为阴极,故$\rm C$正确;
$\rm D$.由分析可知,充电时,电极$\rm N$为阳极,碱性条件下氢氧化镍在阳极失去电子发生氧化反应生成碱式氧化镍和水,电极反应式为$\text{Ni}{{\left( \text{OH} \right)}_{2}}-{{\text{e}}^{-}}+\text{O}{{\text{H}}^{-}}=\text{NiO}\left( \text{OH} \right)+{{\text{H}}_{\text{2}}}\text{O}$,则当两性羟基乙酸铝电离出$\rm 2$ $\rm mol$氢离子时,阳极板质量减少$\rm 2$ $\rm g$,故$\rm D$错误;
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
