高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
水系双离子电池原理如图所示,下列有关叙述正确的是$(\quad\ \ \ \ )$
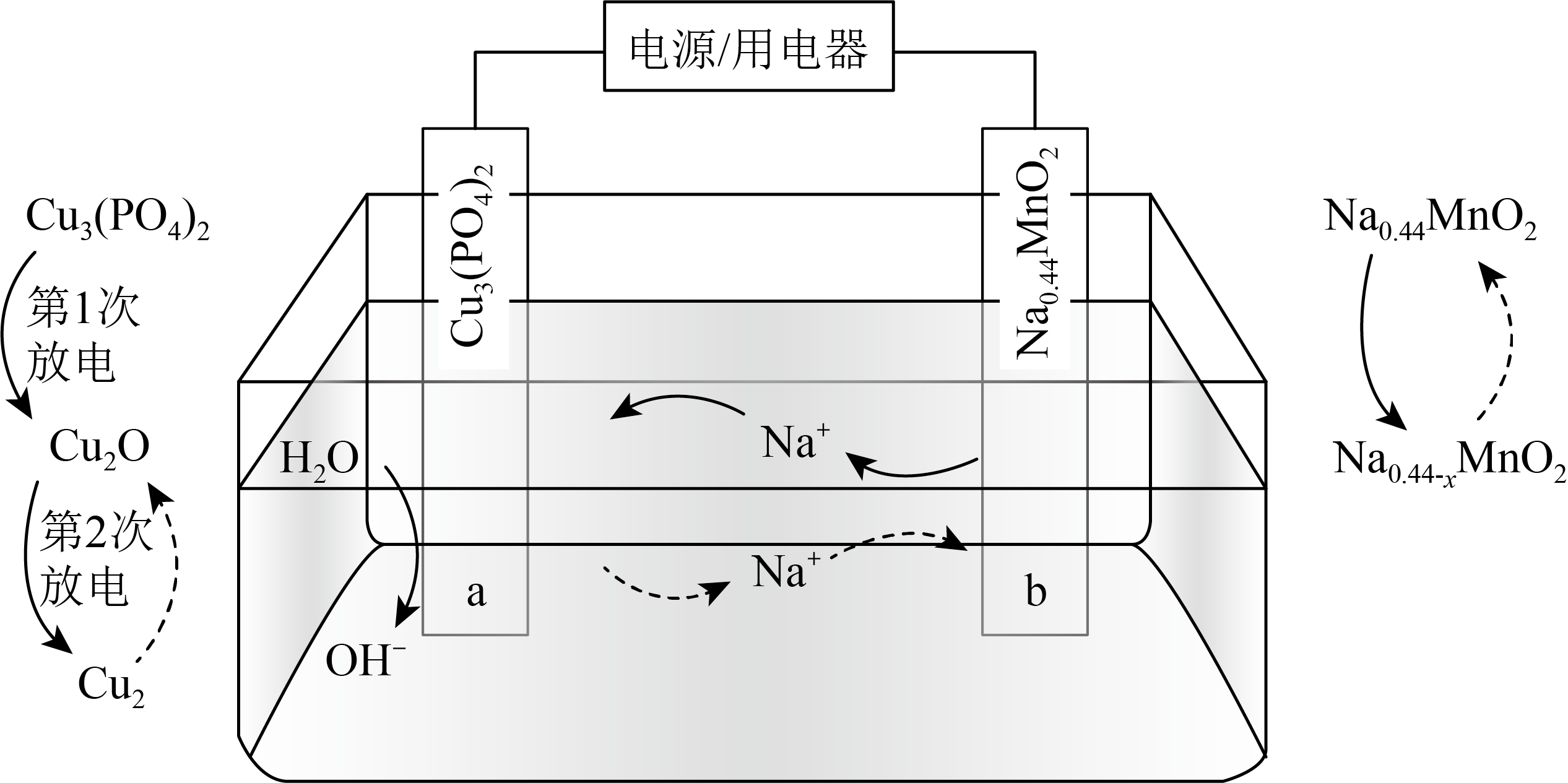
放电时,电极$\\rm a$作电源的正极,$\\rm Cu_{3}(PO_{4})_{2}$发生氧化反应最终变为$\\rm Cu$
","充电时,水系电池中,$\\rm a$电极附近溶液的$\\rm pH$增大
","充电时,$\\rm b$电极上的电极反应式为$\\text{N}{{\\text{a}}_{0.44}}\\text{Mn}{{\\text{O}}_{2}}-x{{\\text{e}}^{-}}=\\text{N}{{\\text{a}}_{0.44-x}}\\text{Mn}{{\\text{O}}_{2}}+x\\text{N}{{\\text{a}}^{+}}$
","当$\\rm 0.5$ $\\rm mol$ $\\rm Cu_{3}(PO_{4})_{2}$完全放电时,则$b$电极质量减轻$\\rm 69\\;\\rm g$
"]由图可知,放电时为原电池,$\rm a$极上$\rm Cu_{3}(PO_{4})_{2}→Cu_{2}O→Cu$、发生得电子的还原反应,$\rm b$极上$\text{N}{{\text{a}}_{\text{0}\text{.44}}}\text{Mn}{{\text{O}}_{2}}\to \text{N}{{\text{a}}_{0.44-x}}\text{Mn}{{\text{O}}_{\text{2}}}$、发生失电子的氧化反应,则$\rm a$极为正极、$\rm b$极为负极,负极反应式为$\text{N}{{\text{a}}_{\text{0}\text{.44}}}\text{Mn}{{\text{O}}_{2}}-x{{\text{e}}^{-}}=\text{N}{{\text{a}}_{0.44-x}}\text{Mn}{{\text{O}}_{2}}+x\text{N}{{\text{a}}^{+}}$,充电时为电解池,原电池的正负极分别与电源的正负极相接,即$\rm a$极为阳极、$\rm b$极为阴极,阴阳极反应与负正极反应相反。
$\rm A$.放电时为原电池,$\rm a$极为正极、$\rm b$极为负极,$\rm Cu_{3}(PO_{4})_{2}$发生还原反应最终变为$\rm Cu$,故$\rm A$错误;
$\rm B$.充电时为电解池,$\rm a$极为阳极、$\rm b$极为阴极,阳极电极反应式为:$\text{2Cu}-2{{\text{e}}^{-}}+2\text{O}{{\text{H}}^{-}}=\text{C}{{\text{u}}_{2}}\text{O+}{{\text{H}}_{\text{2}}}\text{O}$,阳极附近的碱性减弱,故$\rm B$错误;
$\rm C$.充电时为电解池,$\rm a$极为阳极、$\rm b$极为阴极,阴极反应式为:$\text{N}{{\text{a}}_{0.44-x}}\text{Mn}{{\text{O}}_{2}}+x\text{N}{{\text{a}}^{+}}+x{{\text{e}}^{-}}=\text{N}{{\text{a}}_{0.44}}\text{Mn}{{\text{O}}_{2}}$,故$\rm C$错误;
$\rm D$.放电时为原电池,$\rm a$极上$\rm Cu_{3}(PO_{4})_{2}→Cu_{2}O→Cu$,则$\rm 0.5$ $\rm mol$ $\rm Cu_{3}(PO_{4})_{2}$完全放电时,转移电子$\rm 3$ $\rm mol$,有$\rm 3$ $\rm mol$ $\rm Na^{+}$发生迁移,则$\rm b$电极质量减轻$\rm 3$ $\rm mol\times 23$ $\rm g/mol=69$ $\rm g$,故$\rm D$正确;
故选:$\rm D$
高中 | 原电池工作原理题目答案及解析(完整版)
