高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
应用$\rm (CO_{2}$催化加氢规模化生产甲醇是综合利用$\rm (CO_{2}$,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H$ ,需通过以下两步实现:
$\rm I$.$\text{C}{{\text{O}}_{2}}(\text{g})+{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{CO}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{\text{1}}}$
$\rm I$$\rm I$.$\text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})\quad \Delta {{H}_{\text{2}}}$
反应过程中各物质的相对能量变化情况如图所示:
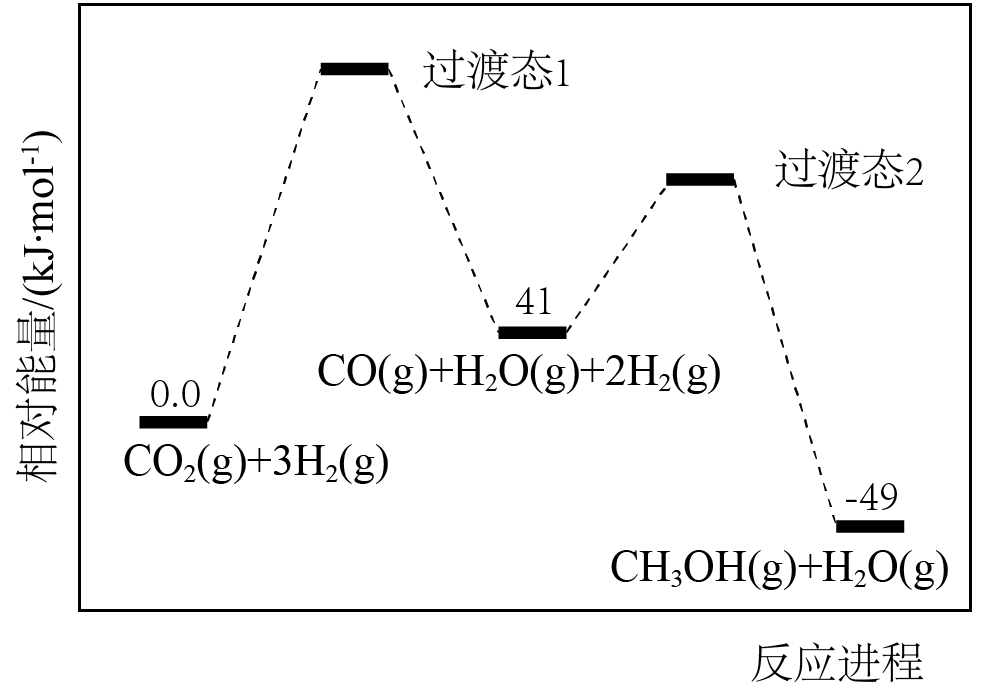 $\Delta {{H}_{\text{2}}}\rm =$ ,反应是快反应 $\rm ($填“Ⅰ”或“Ⅱ”$\rm )$
$\Delta {{H}_{\text{2}}}\rm =$ ,反应是快反应 $\rm ($填“Ⅰ”或“Ⅱ”$\rm )$
$\\rm -90$ $\\rm kJ/mol$ ; Ⅱ
"]]步骤Ⅱ的反应热$\Delta H=$生成物的总能量$\rm -$反应物的总能量$=-49\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}-41\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=-90\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。反应$\rm II$活化能较小,是快反应。
若$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta S=-175\text{ J}\cdot \text{mo}{{\text{l}}^{-1}}\cdot {{\text{K}}^{-1}}$ ,下列温度下反应能自发进行的是 $\rm ($填序号$\rm )$。
$\rm A$.$\rm 0\;\rm ^\circ\rm C$ $\rm B$.$\rm 70\;\rm ^\circ\rm C$ $\rm C$.$\rm 150\;\rm ^\circ\rm C$ $\rm D$.$\rm 280^\circ C$
$\\rm A$
"]]若根据图示$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H=-49\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$ ,$\Delta S=-175\text{ J}\cdot \text{mo}{{\text{l}}^{-1}}\cdot {{\text{K}}^{-1}}=-0.175\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}\cdot {{\text{K}}^{-1}}$,$\Delta G=\Delta H-T\Delta S\lt 0$反应能自发进行,则$-49\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}-T(-0.175\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}\cdot {{\text{K}}^{-1}})\lt 0$,$T\lt 280\text{ K}$,温度低于$\rm 7\;\rm ^\circ\rm C$时反应能自发进行,选$\rm A$。
已知反应$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})$,在$\rm 540$ $\rm K$下,按初始投料$n\left( \text{C}{{\text{O}}_{2}} \right):n\left( {{\text{H}}_{2}} \right)=3:1$、$n\left( \text{C}{{\text{O}}_{2}} \right):n\left( {{\text{H}}_{2}} \right)=1:1$,$n\left( \text{C}{{\text{O}}_{2}} \right):n\left( {{\text{H}}_{2}} \right)=1:3$,得到不同压强条件下$\rm H_{2}$的平衡转化率关系图:
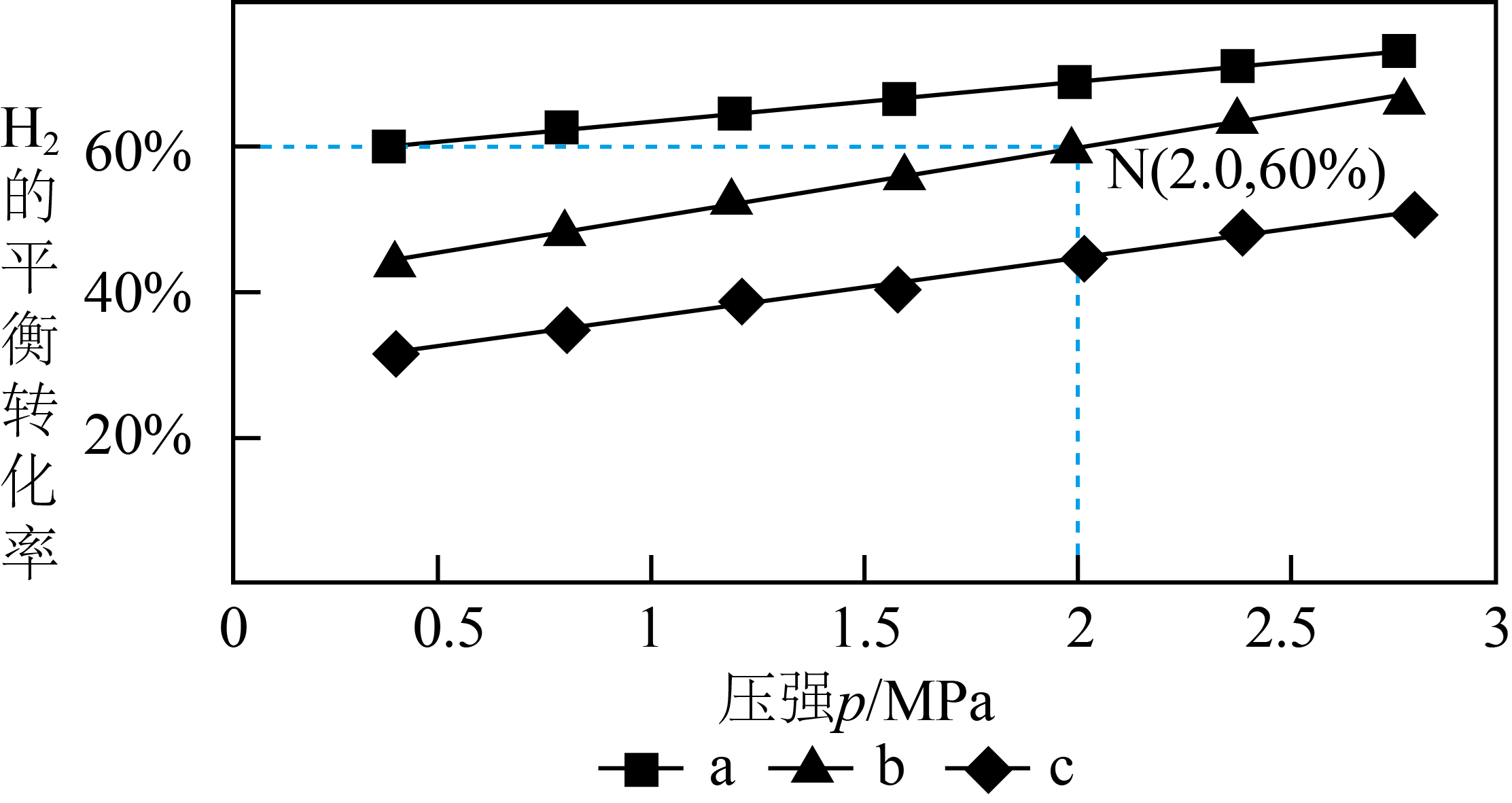
①$\rm a$、$\rm b$、$\rm c$各曲线所表示的投料比由小到大的顺序为 $\rm ($用字母表示$\rm )$。
②$\rm N$点在$\rm b$曲线上,$\rm 540$ $\rm K$时的压强平衡常数${{K}_{\text{p}}}=$ $\rm (MPa)^{-2}($用平衡分压计算$\rm )$。
$\\text{c}\\lt \\text{b}\\lt \\text{a}$ ; $\\rm 0.5$
"]]①两种物质反应,增大二氧化碳的浓度则氢气的平衡转化率会增大,$\rm a$、$\rm b$、$\rm c$各曲线所表示的投料比由小到大的顺序为:$\text{c}\lt \text{b}\lt \text{a}$;
②根据题给数据可得三段式如下:
$\begin{matrix} {} \\ 起始\left( \text{mol} \right) \\ 转化\left( \text{mol} \right) \\ 平衡\left( \text{mol} \right) \\ \end{matrix}\begin{matrix} \text{C}{{\text{O}}_{2}}(\text{g}) & + & 3{{\text{H}}_{2}}(\text{g}) & \rightleftharpoons & \text{C}{{\text{H}}_{3}}\text{OH}(\text{g}) & + & {{\text{H}}_{2}}\text{O}(\text{g}) \\ \text{1} & {} & \text{1} & {} & \text{0} & {} & \text{0} \\ \text{0}\text{.2} & {} & \text{0}\text{.6} & {} & \text{0}\text{.2} & {} & \text{0}\text{.2} \\ \text{0}\text{.8} & {} & \text{0}\text{.4} & {} & \text{0}\text{.2} & {} & \text{0}\text{.2} \\ \end{matrix}$
平衡时气体总物质的量$\rm =1.6$ $\rm mol$,则此时平衡常数$K=\dfrac{p\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)p\left( {{\text{H}}_{\text{2}}}\text{O} \right)}{p\left( \text{C}{{\text{O}}_{\text{2}}} \right){{p}^{\text{3}}}\left( {{\text{H}}_{\text{2}}} \right)}=\dfrac{\dfrac{\text{0}\text{.2}}{\text{1}\text{.6}}\times \text{2}\times \dfrac{\text{0}\text{.2}}{\text{1}\text{.6}}\times \text{2}}{\dfrac{\text{0}\text{.8}}{\text{1}\text{.6}}\times \text{2}\times {{\left( \dfrac{\text{0}\text{.4}}{\text{1}\text{.6}}\times \text{2} \right)}^{\text{3}}}}\text{=0}\text{.5}$。
恒压下,分别向无分子筛膜和有分子筛膜$\rm ($能选择性分离出$\rm )H$?$\rm O)$的两个同体积容器中通入$\rm 1$ $\rm mol$ $\rm CO_{2}$和$\rm 3$ $\rm mol$ $\rm H_{2}$,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为 。
分子筛膜能不断分离出$\\rm H_{2}O(g)$,有利于反应正向进行
"]]温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为:分子筛膜能不断分离出$\rm H_{2}O(g)$,有利于反应正向进行。
通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物$\text{C}{{\text{O}}_{x}}$。请写出燃料电池负极反应方程式 。
$\\text{C}{{\\text{H}}_{3}}\\text{OH}-(2x+2){{\\text{e}}^{-}}+(x-1){{\\text{H}}_{2}}\\text{O}=\\text{C}{{\\text{O}}_{x}}+(2x+2){{\\text{H}}^{+}}$
"]]酸性电解质溶液中,甲醇在负极上失去电子产生碳氧化物$\text{C}{{\text{O}}_{x}}$,根据得失电子守恒和电荷守恒配平负极反应方程式为:$\text{C}{{\text{H}}_{3}}\text{OH}-(2x+2){{\text{e}}^{-}}+(x-1){{\text{H}}_{2}}\text{O}=\text{C}{{\text{O}}_{x}}+(2x+2){{\text{H}}^{+}}$。
高中 | 化学平衡常数题目答案及解析(完整版)
