| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
元素周期表和元素周期律可用于理解和预测元素及其化合物的性质。实验小组为探究$\rm CuX$溶解性的变化,开展如下研究活动。
Ⅰ.分析结构,预测性质
$\rm Cu$是$\rm 29$号元素,其基态原子的电子排布式为 。
$\\left[ \\text{Ar} \\right]\\text{3}{{\\text{d}}^{\\text{10}}}\\text{4}{{\\text{s}}^{\\text{1}}}$
"]]$\rm Cu$是$\rm 29$号元素,该元素原子的核外电子排布式应为$\text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{6}}}\text{3}{{\text{s}}^{\text{2}}}\text{3}{{\text{p}}^{\text{6}}}\text{3}{{\text{d}}^{\text{10}}}\text{4}{{\text{s}}^{\text{1}}}$;
元素周期表中,$\rm Ag$与$\rm Cu$同列且位于$\rm Cu$的下一行,$\rm Ag$位于第$(\quad\ \ \ \ )$。
$\\rm 4$周期Ⅱ$\\rm B$
","$\\rm 5$周期$\\rm IB$
","$\\rm 6$周期$\\rm IA$
","$\\rm 7$周期Ⅱ$\\rm B$
"]$\rm Cu$是第四周期$\rm IB$族,$\rm Ag$与$\rm Cu$同列且位于$\rm Cu$的下一行,则$\rm Ag$位于第五周期$\rm IB$族,答案选$\rm B$。
预测$\rm CuCl$、$\rm CuBr$、$\rm CuI$的溶解度依次减小,可能的依据是 。
从$\\text{C}{{\\text{l}}^{-}}$到$\\mathrm{I}^{-}$,卤素离子的变形性依次增大,导致$\\text{C}{{\\text{u}}^{+}}$对卤素离子的极化作用依次增强,从而使得卤化亚铜的共价性依次增强,溶解度依次减小
"]]$\rm CuCl$、$\rm CuBr$、$\rm CuI$的溶解度依次减小,可能的依据是:从$\text{C}{{\text{l}}^{-}}$到$\mathrm{I}^{-}$,卤素离子的变形性依次增大,导致$\text{C}{{\text{u}}^{+}}$对卤素离子的极化作用依次增强,从而使得卤化亚铜的共价性依次增强,溶解度依次减小。
Ⅱ.查阅资料,设计实验
资料①:
| 难溶物 | $\rm CuCl($白色$\rm )$ | $\rm CuBr($白色$\rm )$ | $\rm CuI($白色$\rm )$ |
| $K_{\rm sp}(25\;\rm ^\circ\rm C)$ | $1.2\times {{10}^{-6}}$ | $5.3\times {{10}^{-9}}$ | $1.1\times {{10}^{-12}}$ |
将$\rm 2.475\;\rm g\;\rm CuCl$加入$\rm 100\;\rm mL\;\rm 0.1000\;\rm mol·L^{-1}\;NaBr$溶液中,充分搅拌后,静置,计算此时溶液中$\rm Br^-$的浓度 ;后经过滤、洗涤、干燥、称量,理论上得到固体的质量 。$\rm ($写出计算过程,忽略溶液体积变化$\rm )$
已知:$ {M}\left( \text{CuCl} \right)\text{=99}\text{.00}\;\rm g·mol^{-1}$;$ {M}\left( \text{CuBr} \right)\text{=143}\text{.45}\;\rm g·mol^{-1}$
$4.4\\times {{10}^{-4}}\\;\\rm mol/L$;$\\rm 2.92\\;\\rm g$
"]]$\rm 2.475\;\rm g\;\rm CuCl$物质的量是$\rm 0.025\;\rm mol$,$\rm 100\;\rm mL\;\rm 0.1000\;\rm mol/L\;NaBr$溶液中,${n}\left(\rm B{{r}^{-}} \right)=0.01\;\rm mol$,饱和溶液中${c}\left(\rm C{{u}^{+}} \right)=\sqrt{{{{K}}_{\rm sp}}\left(\rm CuCl \right)}=\sqrt{1.2}\times {{10}^{-3}}\;\rm mol/{L}$,说明$\rm CuCl$不能完全溶解,还有$\rm CuCl$剩余,发生反应:$\rm CuCl\left( {s} \right)+B{{r}^{-}}\left( aq \right)\rightleftharpoons CuBr\left( {s} \right)+C{{l}^{-}}\left( aq \right)$的平衡常数$ K=\dfrac{{c}\left(\rm C{{l}^{-}} \right)}{{c}\left(\rm B{{r}^{-}} \right)}=\dfrac{{c}\left(\rm C{{l}^{-}} \right)\times {c}\left(\rm C{{u}^{+}} \right)}{{c}\left(\rm B{{r}^{-}} \right)\times {c}\left(\rm C{{u}^{+}} \right)}=\dfrac{{{{K}}_{\rm sp}}\left(\rm CuCl \right)}{{{{K}}_{\rm sp}}\left(\rm CuBr \right)}=\dfrac{1.2}{5.3}\times {{10}^{3}}$,平衡常数很大,$\rm B{{r}^{-}}$趋近于完全反应,则生成${n}\left(\rm C{{l}^{-}} \right)\approx 0.01\;\rm mol$,根据平衡常数$\dfrac{{c}\left(\rm C{{l}^{-}} \right)}{{c}\left(\rm B{{r}^{-}} \right)}=\dfrac{0.1\;\rm mol/{L}}{{c}\left(\rm B{{r}^{-}} \right)}=\dfrac{1.2}{5.3}\times {{10}^{3}}$,解得${c}\left(\rm B{{r}^{-}} \right)\approx 4.4\times {{10}^{-4}}\;\rm mol/{L}$;理论上$\rm B{{r}^{-}}$完全转化为$\rm CuBr$沉淀,则过滤、洗涤、干燥、称量,理论上得到固体的为$0.01\;\rm mol\;\rm CuBr$和$0.015\;\rm mol\;\rm CuCl$,质量约为$\rm 2.92\;\rm g$。
Ⅲ.验证假设,得出结论
向试管$\rm a$、$\rm b$中分别依次滴加同浓度、等体积足量的氯水和四氯化碳,振荡、静置,若观察到 ,说明$\rm CuCl$的溶解度大于$\rm CuBr$。
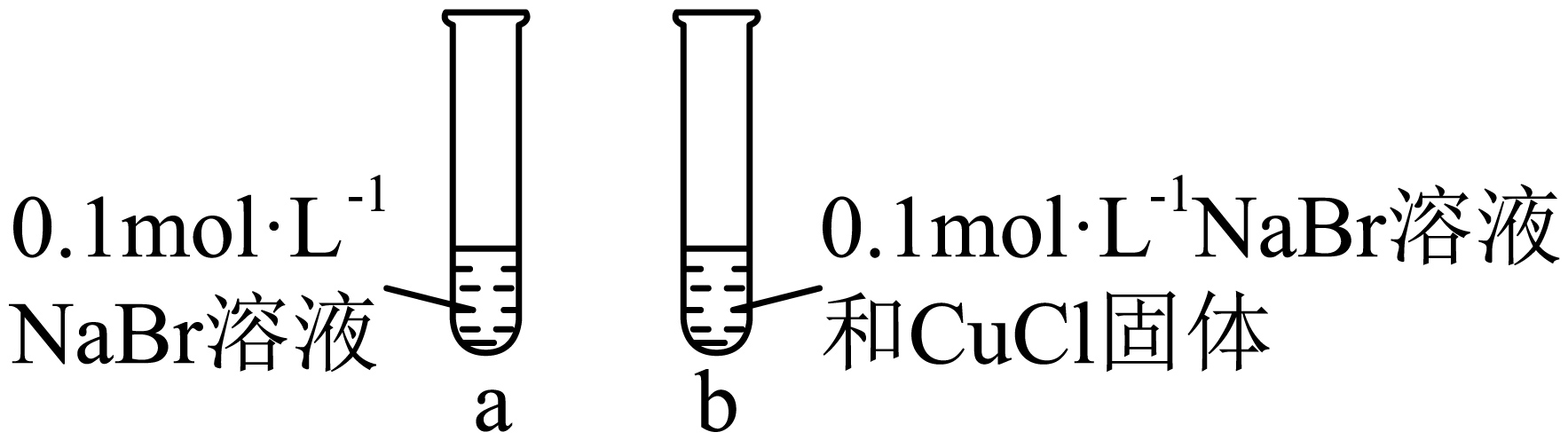
$\\rm a$中有机层为红棕色,$\\rm b$中有机层较$\\rm a$中浅
"]]向试管$\rm a$、$\rm b$中分别依次滴加同浓度、等体积足量的氯水和四氯化碳,试管$\rm a$中氯气将溴离子氧化为溴单质,单质溴溶于四氯化碳有机层显红棕色,$\rm CuCl$的溶解度大于$\rm CuBr$ ,说明$\rm CuCl$转化为$\rm CuBr$,试管$\rm b$溶液中不存在溴离子,则通入氯气无红棕色出现,故现象为:$\rm a$出现分层且下层显红棕色,$\rm b$中有机层较$\rm a$中浅。
资料②:$\rm \text{C}{{\text{u}}^{+}}$不稳定,易在水溶液中发生反应:$\rm \text{2C}{{\text{u}}^{+}}\text{=Cu+C}{{\text{u}}^{\text{2+}}}$
实验小组搭建装置$\rm c\sim g$。闭合$\rm K$,观察到电流计指针变化情况如下:$\rm c$中无偏转,$\rm d$中略有偏转,$\rm e$中偏转幅度较大。一段时间后,$\rm e$中盛放稀$\rm {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$的烧杯中溶液变蓝色,盛放$\rm \text{CuB}{{\text{r}}_{\text{2}}}$溶液的烧杯中出现少量白色沉淀。$\rm ($所有溶液均无$\rm {{\text{O}}_{\text{2}}}$溶解,溶液浓度均为$\rm 0.1\;\rm mol·L^{-1})$
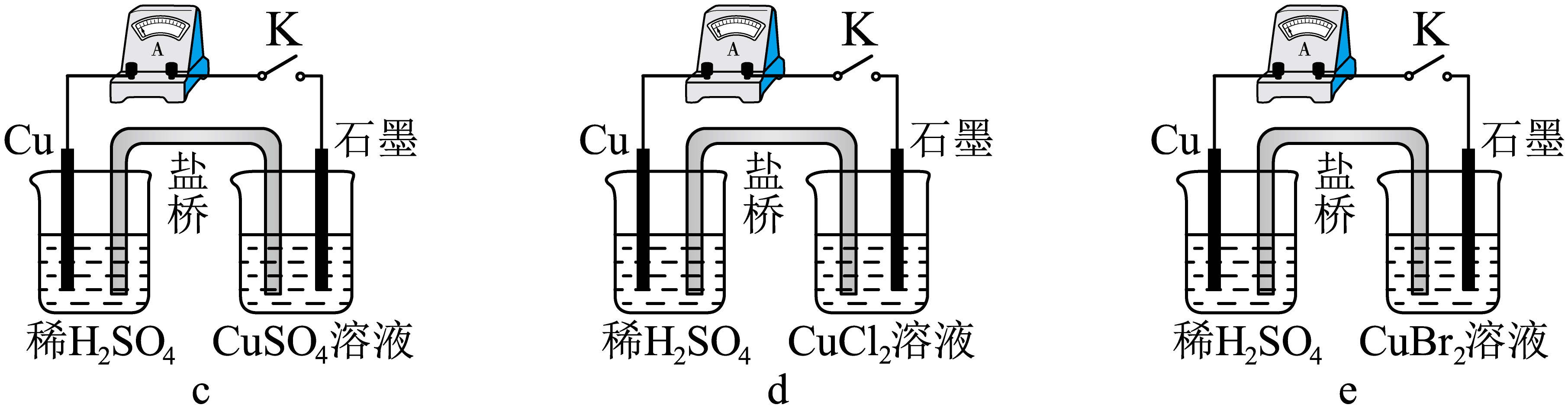
$\rm e$中,负极是 ,正极的电极反应式为 。
$\rm A$.铜 $\rm B$.石墨
$\\rm A$;$\\text{C}{{\\text{u}}^{\\text{2+}}}+{{\\text{e}}^{-}}\\text{+B}{{\\text{r}}^{-}}\\text{=CuBr}\\downarrow $
"]]一段时间后,$\rm e$中盛放稀${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$的烧杯中溶液变蓝色,盛放$\rm CuBr_{2}$溶液的烧杯中出现少量白色沉淀即$\rm CuBr$,说明$\rm Cu$失去电子生成$\rm Cu^{2+}$,负极是$\rm Cu$,选$\rm A$;正极是石墨,铜离子得电子生成$\rm CuBr$,电极反应式为$\text{C}{{\text{u}}^{\text{2+}}}+{{\text{e}}^{-}}\text{+B}{{\text{r}}^{-}}\text{=CuBr}\downarrow $。
对$\rm c$、$\rm d$、$\rm e$的分析正确的是$\rm (\quad\ \ \ \ )$。
$\\rm c$中没有自发进行的氧化还原反应,不能构成原电池
","$\\rm c$中有活泼性不同的导体、电解质溶液、闭合回路,符合构成原电池的条件
","$\\rm e$中石墨电极上发生氧化反应
","$\\rm CuBr$的溶解度更小,$\\rm \\text{C}{{\\text{u}}^{+}}$更易形成沉淀析出,使$\\rm Cu$还原性增强更多
"]$\rm A$.$\rm c$中无偏转,说明没有电子产生,即$\rm c$中没有自发进行的氧化还原反应,不能构成原电池,故$\rm A$正确; $\rm B$.$\rm c$中无偏转,$\rm Cu$的活泼性比酸中还弱,不能发生自发进行的氧化还原反应,没有构成原电池的条件,故$\rm B$错误;
$\rm C$.$\rm e$中正极是石墨,$\rm e$中石墨电极上发生还原反应,故$\rm C$错误;
$\rm D$.盛放$\rm CuBr_{2}$溶液的烧杯中出现少量白色沉淀即$\rm CuBr$,$\rm CuBr$的溶解度更小,$\rm Cu^{+}$更易形成沉淀析出,使$\rm Cu$还原还原性增强更多,故$\rm D$正确;
故选:$\rm AD$。
装置$\rm f$、$\rm g$中,观察到电流计的偏转幅度:$\rm g$中大于$\rm f$。
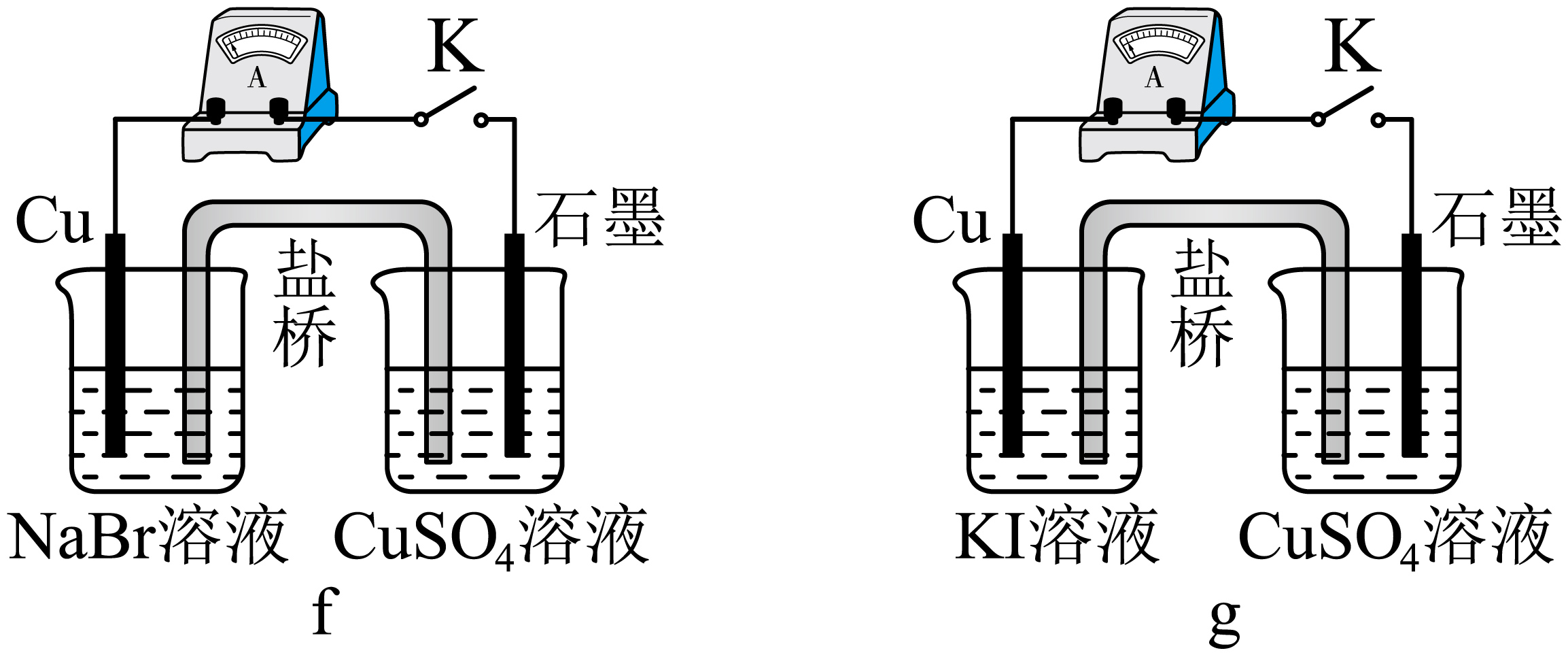
可推断,一段时间后,$\rm g$中:铜片上有白色固体附着,右侧烧杯中的现象是 。
石墨表面有红色固体析出
"]]$\rm g$中$\rm Cu$是负极,失去电子与碘离子生成$\rm CuI$,铜片上有白色固体附着,石墨是正极,铜离子得电子生成$\rm Cu^{+}$,根据资料可知$\rm Cu^{+}$不稳定,易在水溶液中发生反应: $\rm 2Cu^{+} =Cu+ Cu^{2+}$,右侧烧杯中的现象是有红色固体产生。
| 化学平衡常数题目答案及解析(完整版)
