| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\text{MgC}{{\text{O}}_{\text{3}}}\rm /\text{MgO}$循环在$\text{C}{{\text{O}}_{\text{2}}}$捕获及转化等方面具有重要应用。科研人员设计了利用$\text{MgC}{{\text{O}}_{\text{3}}}$与${{\text{H}}_{\text{2}}}$反应生成$\text{C}{{\text{H}}_{\text{4}}}$的路线,主要反应如下:
$\rm I$.$\text{MgC}{{\text{O}}_{\text{3}}}\text{(s)=MgO(s)+C}{{\text{O}}_{\text{2}}}\text{(g)}\quad \Delta {{H}_{\text{1}}}\text{=+101 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
$\rm I$$\rm I$.$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+4}{{\text{H}}_{\text{2}}}\text{(g)=C}{{\text{H}}_{\text{4}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta {{H}_{\text{2}}}\text{=-166 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
$\rm II$$\rm I$.$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+}{{\text{H}}_{\text{2}}}\text{(g)=}{{\text{H}}_{\text{2}}}\text{O(g)+CO(g)}\quad \Delta {{H}_{\text{3}}}\text{=+41 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
回答下列问题,
计算$\text{MgC}{{\text{O}}_{\text{3}}}\text{(s)+4}{{\text{H}}_{\text{2}}}\text{(g)=MgO(s)+2}{{\text{H}}_{\text{2}}}\text{O(g)+C}{{\text{H}}_{\text{4}}}\text{(g)}\quad \Delta {{H}_{\text{4}}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。
$-65$
"]]已知:
$\rm I$.$\text{MgC}{{\text{O}}_{\text{3}}}\text{(s)=MgO(s)+C}{{\text{O}}_{\text{2}}}\text{(g)}\quad \Delta {{H}_{\text{1}}}\text{=+101 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
Ⅱ.$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+4}{{\text{H}}_{\text{2}}}\text{(g)=C}{{\text{H}}_{\text{4}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta {{H}_{\text{2}}}\text{=-166 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
将$\rm I+$ Ⅱ可得$\text{MgC}\text{O}_{\text{3}}\text{(s)+4}\text{H}_{\text{2}}\text{(g)}=\text{MgO(s)+2}\text{H}_{\text{2}}\text{O(g)+C}\text{H}_{\text{4}}\text{(g)}\quad\Delta H_{\text{4}}=\Delta H_{1}+\Delta H_{2}=\text{+101 kJ}\cdot\text{mo}\text{l}^{\text{-1}}+(\text{-166 kJ}\cdot\text{mo}\text{l}^{\text{-1}})=-65\text{ kJ}\cdot\text{mo}\text{l}^{\text{-1}}$ ;
提高$\text{C}{{\text{H}}_{\text{4}}}$平衡产率的条件是 。
$\rm A$.高温高压 $\rm B$.低温高压 $\rm C$.高温低压 $\rm D$.低温低压
$\\rm B$
"]]已知反应Ⅱ.$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+4}{{\text{H}}_{\text{2}}}\text{(g)=C}{{\text{H}}_{\text{4}}}\text{(g)+2}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta {{H}_{\text{2}}}\text{=-166 kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$ 为放热反应,要提高$\text{C}{{\text{H}}_{\text{4}}}$平衡产率,要使平衡正向移动。
$\rm A$.高温会使平衡逆向移动,不利于提高$\rm \text{C}{{\text{H}}_{\text{4}}}$平衡产率,$\rm A$错误;
$\rm B$.低温使平衡正向移动,高压也使平衡正向移动,可提高$\rm \text{C}{{\text{H}}_{\text{4}}}$平衡产率,$\rm B$正确;
$\rm C$.高温会使平衡逆向移动,低压会使平衡逆向移动,不利于提高$\rm \text{C}{{\text{H}}_{\text{4}}}$平衡产率,$\rm C$错误;
$\rm D$.低压会使平衡逆向移动,不利于提高$\rm \text{C}{{\text{H}}_{\text{4}}}$平衡产率,$\rm D$错误;
高温下$\text{MgC}{{\text{O}}_{\text{3}}}$分解产生的$\text{MgO}$催化$\text{C}{{\text{O}}_{\text{2}}}$与${{\text{H}}_{\text{2}}}$反应生成$\text{C}{{\text{H}}_{\text{4}}}$,部分历程如图,其中吸附在催化剂表面的物种用*标注,所示步骤中最慢的基元反应是 $\rm ($填序号$\rm )$,生成水的基元反应方程式为 。
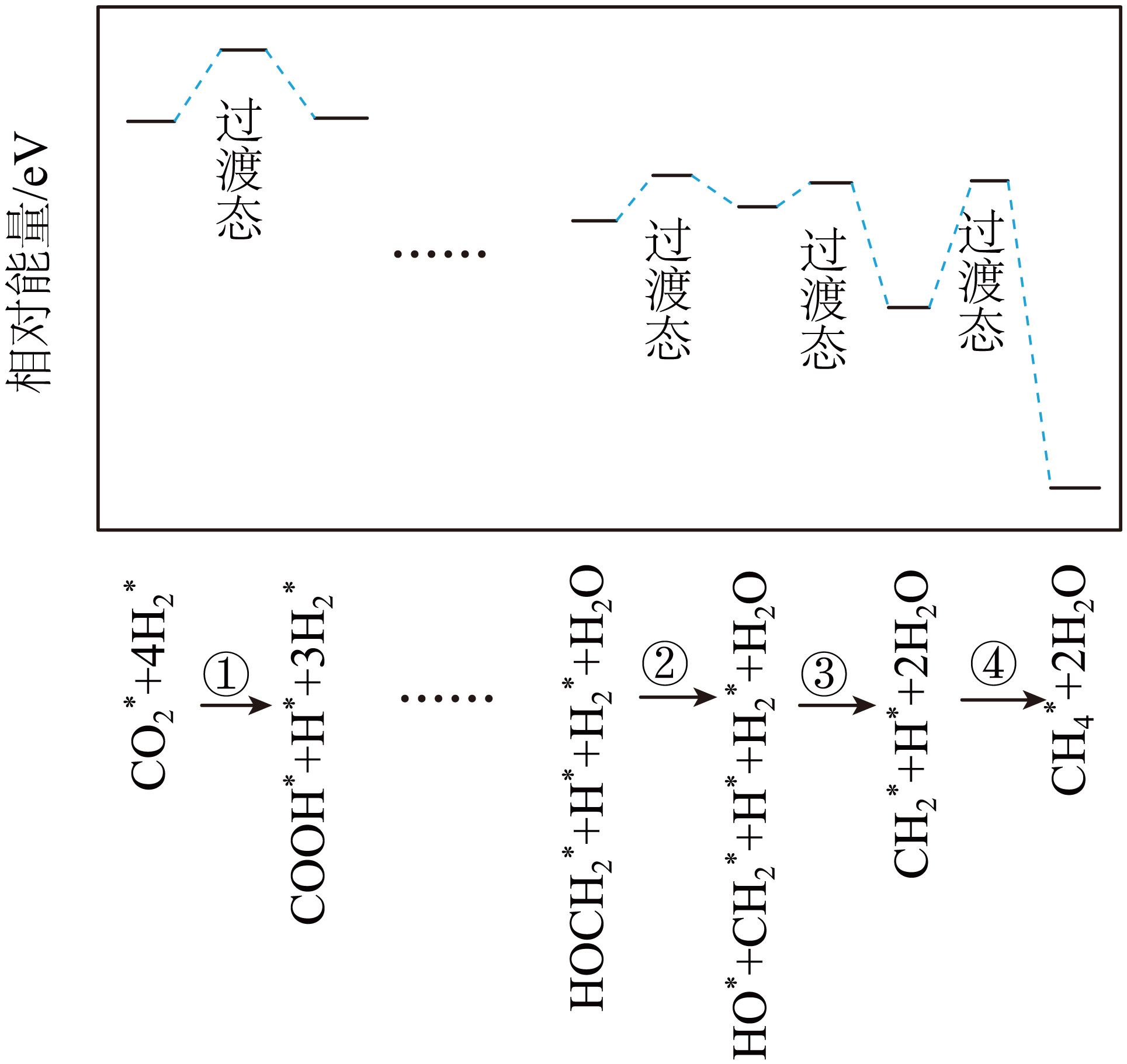
④ ; $\\rm HO$*$\\rm +H_{2}$*$\\rm +CH_{2}$*$\\rm =$ $\\rm CH_{3}$*$\\rm +H_{2}O$
"]]反应活化能越高,反应速率越慢,从图中可以看出,第四步活化能最高,速率最慢,基元反应为$\rm CH_{3}$*$\rm +H$*$\rm +2H_{2}O=CH_{4}$*$\rm +2H_{2}O$;由图可知,在第三步时生成了水,基元反应为:$\rm HO$*$\rm +H_{2}$*$\rm +CH_{2}$*$\rm =$ $\rm CH_{3}$*$\rm +H_{2}O$;
$\text{100\;\rm kPa}$下,在密闭容器中${{\text{H}}_{\text{2}}}\text{(g)}$和$\text{MgC}{{\text{O}}_{\text{3}}}\text{(s)}$各$\text{1\;\rm mol}$发生反应。反应物$\rm ({{\text{H}}_{\text{2}}}$、$\text{MgC}{{\text{O}}_{\text{3}}}\rm )$的平衡转化率和生成物$\rm (\text{C}{{\text{H}}_{\text{4}}}$、$\text{C}{{\text{O}}_{\text{2}}}\rm )$的选择性随温度变化关系如下图$\rm ($反应$\rm III$在$360\text{ }{}^\circ \text{C}$以下不考虑$\rm )$。
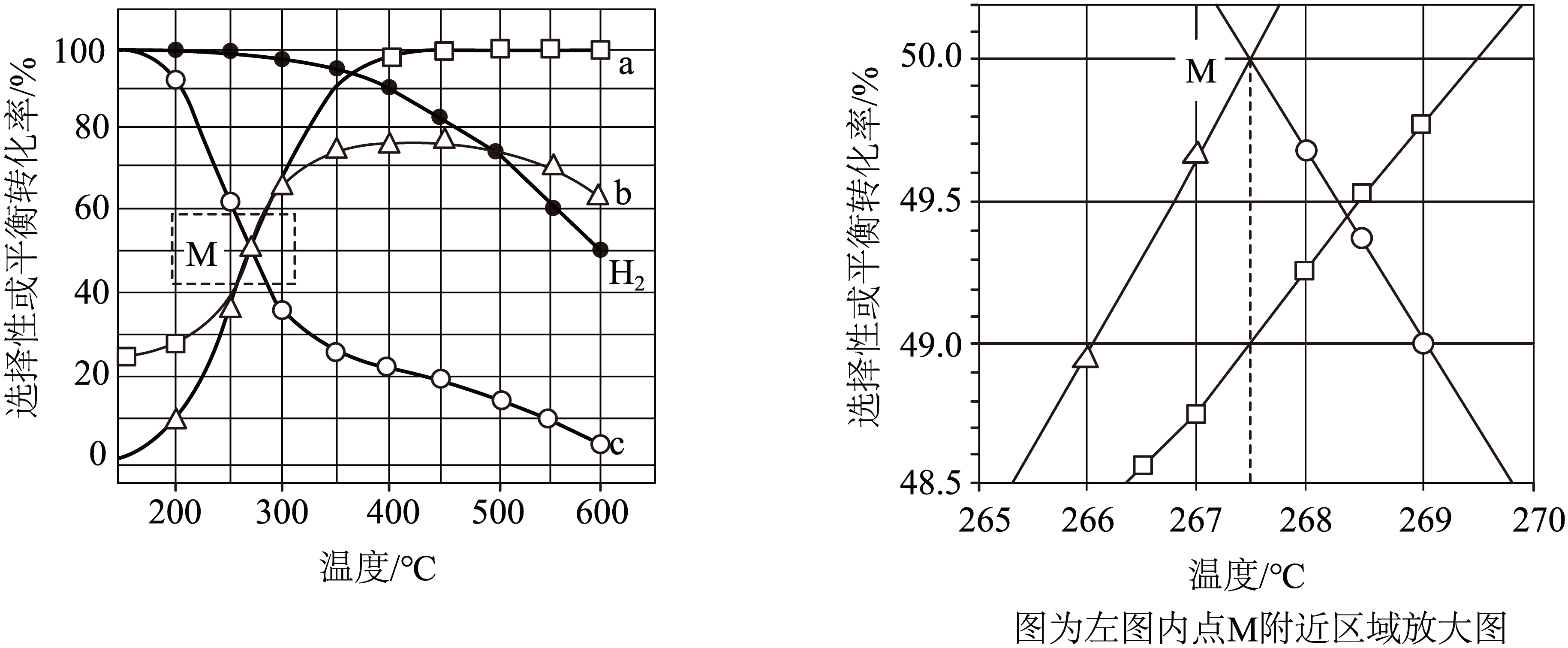
注:含碳生成物选择性$=\dfrac{含碳生成物的物质的量}{\text{MgC}{{\text{O}}_{\text{3}}}转化的物质的量}\times 100\%$
①表示$\text{C}{{\text{H}}_{\text{4}}}$选择性的曲线是 $\rm ($填字母$\rm )$。
②点$\rm M$温度下,反应Ⅱ的${{K}_{\text{p}}}=$ ${{\left( \text{kPa} \right)}^{\text{-2}}}\rm ($列出计算式即可$\rm )$。
③在$550\text{ }{}^\circ \text{C}$下达到平衡时,$n\text{(CO)=}$ $\;\rm \text{mol}$。$500\sim 600\ {}^\circ \text{C}$,随温度升高${{\text{H}}_{\text{2}}}$平衡转化率下降的原因可能是 。
$c$ ; $\\dfrac{{{49}^{2}}}{{{2}^{4}}}$ ; $\\rm 0.2$ ; 反应Ⅱ生成的氢气多于反应Ⅲ消耗的氢气
"]]已知反应$\rm I$为吸热反应, Ⅱ为放热反应,$\rm III$为吸热反应,根据图像,温度逐渐升高,则碳酸镁的转化率逐渐升高,氢气的转化率下降,在$360{}^\circ \text{C}$以下不考虑反应Ⅲ,则二氧化碳的选择性上升,甲烷的选择性下降,所以$a$表示碳酸镁的转化率,$b$表示二氧化碳的选择性,$c$表示甲烷的选择性。
①表示$\text{C}{{\text{H}}_{\text{4}}}$选择性的曲线是$c$;
②点$\rm M$温度下,从图中看出碳酸镁的转化率为$\rm 49\%$,则剩余的碳酸镁为$\rm 0.51$ $\rm mol$,根据碳原子守恒,甲烷和二氧化碳中碳原子的物质的量之和为$\rm 0.49$ $\rm mol$,又因为此时二氧化碳的选择性和甲烷的选择性相等,则二氧化碳和甲烷的物质的量为$\rm 0.245$ $\rm mol$,根据氧原子守恒得出水的物质的量为$\rm 0.49$ $\rm mol$,根据氢原子守恒得出 氢气的物质的量为$\rm 0.02$ $\rm mol$,总的物质的量为$\rm 0.02+0.245+0.245+0.49=1$ $\rm mol$,$P\left( {{\text{H}}_{2}} \right)=\dfrac{\text{0}\text{.02}}{\text{1}}\times \text{100 kPa=2 kPa}$,$P\text{(C}{{\text{O}}_{\text{2}}}\text{)=}P\text{(C}{{\text{H}}_{\text{4}}}\text{)=}\dfrac{\text{0}\text{.245}}{\text{1}}\times \text{100 kPa=24}\text{.5 kPa}$,$P\left( {{\text{H}}_{2}}\text{O} \right)=\dfrac{\text{0}\text{.49}}{\text{1}}\times \text{100 kPa=49 kPa}$,则反应Ⅱ的${{K}_{\text{p}}}=\dfrac{24.5\times {{49}^{2}}}{{{2}^{4}}\times 24.5}=\dfrac{{{49}^{2}}}{{{2}^{4}}}$ ;
③在$550\text{ }{}^\circ \text{C}$下达到平衡时,碳酸镁完全转化,二氧化碳的选择性为$\rm 70\%$,甲烷的选择性为$\rm 10\%$,则生成的二氧化碳为$\rm 0.7\;\rm mol$,生成的甲烷为$\rm 0.1\;\rm mol$,根据碳原子守恒得出$n\text{(CO)=}\rm 1-0.7-0.1$ $\rm mol=0.2$ $\rm mol$;因为反应Ⅱ是放热的,反应Ⅲ是吸热的。在$500\sim 600\text{ }{}^\circ \text{C}$,随温度升高,反应Ⅱ逆向移动,反应Ⅲ正向移动,由于反应Ⅱ生成的氢气多于反应Ⅲ消耗的氢气,导致${{\text{H}}_{\text{2}}}$平衡转化率下降。
| 化学平衡常数题目答案及解析(完整版)
