| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
已知$\rm C{{u}^{2+}}$和$\rm {{L}^{3-}}$结合形成两种配离子$\rm {{\left[ CuL \right]}^{-}}$和$\rm {{\left[ Cu{{L}_{2}} \right]}^{4-}}$常温下,$\rm 0.100\ mol\cdot {{L}^{-1}}$的$\rm {{H}_{3}}L$和$\rm 0.002\ mol\cdot {{L}^{-1}}$的$\rm CuS{{O}_{4}}$混合溶液中,$\rm H{{L}^{2-}}$和$\rm {{L}^{3-}}$的浓度对数$\lg c{\rm (实线)}$、含铜微粒的分布系数$\rm \delta($虚线$\rm )[$例如$ {{\delta}_{\rm C{{u}^{2+}}}}=\dfrac{c{\rm (C{{u}^{2+}})}}{c{\rm (C{{u}^{2+}})}+c{\rm ({{\left[ CuL \right]}^{-}})}+c{\rm ({{\left[ Cu{{L}_{2}} \right]}^{4-}})}}]$与溶液$\rm pH$的关系如图所示:
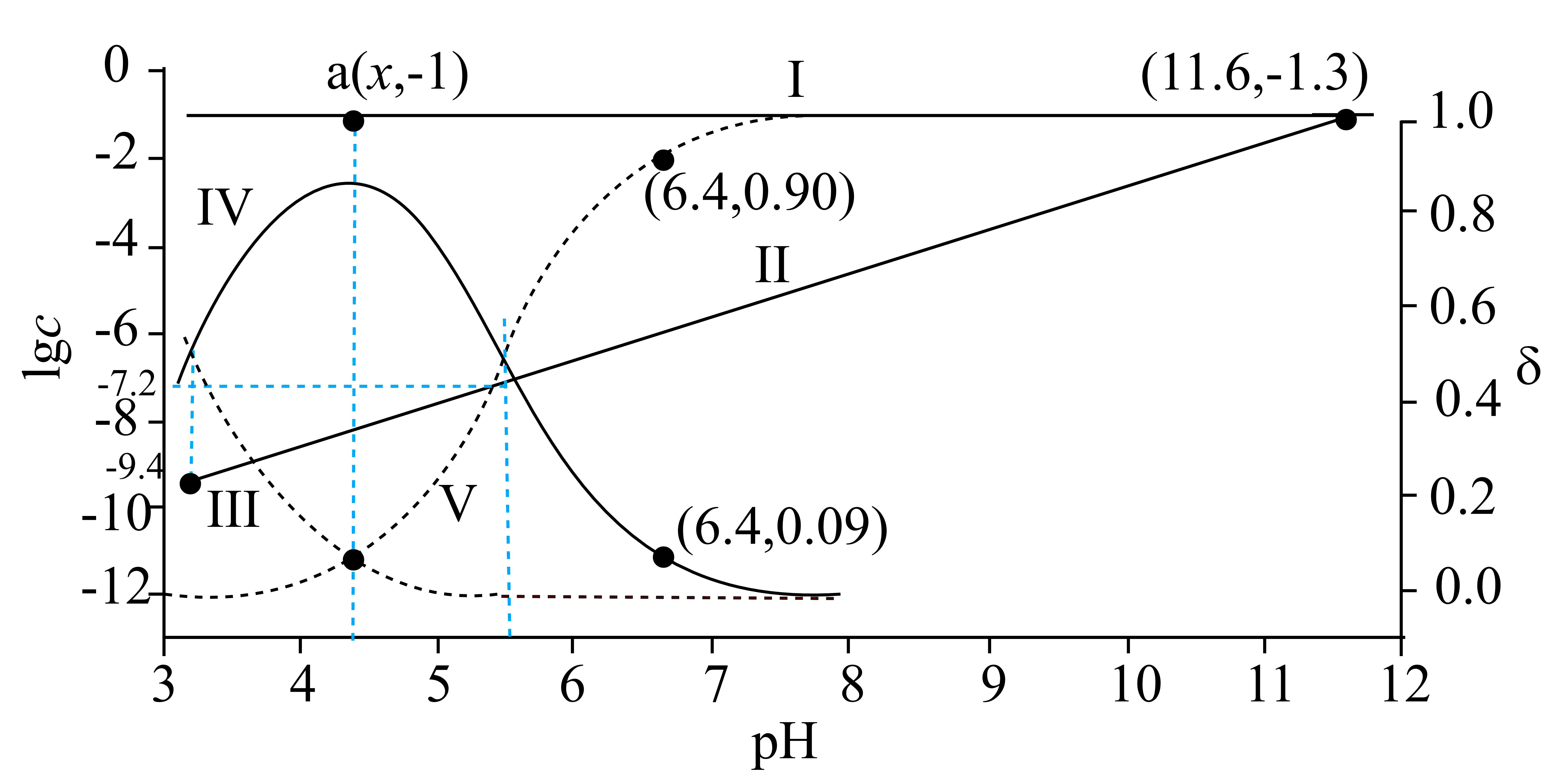
下列说法错误的是$\rm (\qquad)$
$\\rm C{{u}^{2+}}+{{L}^{3-}}\\rightleftharpoons {{[CuL]}^{-}}$,$K={{10}^{9.4}}$
","$\\rm H{{L}^{2-}}\\rightleftharpoons {{H}^{+}}+{{L}^{3-}}$,$K={{10}^{-11.6}}$
","图中$\\rm a$点对应的$\\rm pH=4.2$
","当$\\rm pH=6.4$时,体系中$c{\\rm (H{{L}^{2-}})}\\gt c{\\rm ({{\\left[ Cu{{L}_{2}} \\right]}^{4-}})}\\gt c{\\rm ({{\\left[ CuL \\right]}^{-}})}\\gt c{\\rm ({{L}^{3-}})}$
"]$\rm H{{L}^{2-}}$和$\rm {{L}^{3-}}$之间存在$\rm H{{L}^{2-}}\rightleftharpoons {{H}^{+}}+{{L}^{3-}}$转化关系,则$\rm pH$较小时,平衡逆向移动,以$\rm H{{L}^{2-}}$为主,则$c{\rm (H{{L}^{2-}})}\gt c{\rm ({{L}^{3-}})}$,${\rm lg} c{\rm (H{{L}^{2-}})}\gt \lg c{\rm ({{L}^{3-}})}$,则曲线$\rm I$代表$\lg c{\rm (H{{L}^{2-}})}$,曲线$\rm II$代表$\lg c{\rm ({{L}^{3-}})}$,随着$\rm pH$增大,$\rm H{{L}^{2-}}\rightleftharpoons {{H}^{+}}+{{L}^{3-}}$正向移动,$c{\rm ({{L}^{3-}})}$增大,$\rm C{{u}^{2+}}$和$\rm {{L}^{3-}}$结合形成配离子的反应依次为${\rm C{{u}^{2+}}+{{L}^{3-}}\rightleftharpoons {{\left[ CuL \right]}^{-}} }\quad{{K}_{1}}$、${\rm {{L}^{3-}}+{{\left[ CuL \right]}^{-}}\rightleftharpoons {{\left[ Cu{{L}_{2}} \right]}^{4-}}}\quad {{K}_{2}}$,因此随$\rm pH$增大,$\rm {{\delta}_{C{{u}^{2+}}}}$持续减小,为曲线$\rm III$,$\rm {{\delta}_{{{\left[ CuL \right]}^{-}}}}$,先增大后减小,为曲线$\rm IV$,$\rm {{\delta}_{{{\left[ Cu{{L}_{2}} \right]}^{4-}}}}$一直增大,为曲线$\rm V$,据此回答。
$\rm A$.曲线$\rm III$和曲线$\rm IV$的交点代表$\rm {{\delta}_{C{{u}^{2+}}}}={{\delta}_{{{\left[ CuL \right]}^{-}}}}$,即$c{\rm (C{{u}^{2+}})}=c{\rm ({{\left[ CuL \right]}^{-}})}$,由图可知,此时$ \lg c{\rm ({{L}^{3-}})}=-9.4$,带入平衡表达式得$ {{K}_{1}}=\dfrac{c{\rm ({{\left[ CuL \right]}^{-}})}}{c{\rm (C{{u}^{2+}})}c{\rm ({{L}^{3-}})}}=\dfrac{1}{{{10}^{-9.4}}}={{10}^{9.4}}$,$\rm A$正确;
$\rm B$.曲线$\rm I$和曲线$\rm II$的交点代表$\lg c{\rm ({{L}^{3-}})}=\lg c{\rm (H{{L}^{2-}})}$,即$c{\rm ({{L}^{3-}})}=c{\rm (H{{L}^{2-}})}$,此时$\rm pH=11.6$,带入平衡常数表达式得$K=\dfrac{c{\rm ({{L}^{3-}})}\cdot c{\rm ({{\operatorname{H}}^{+}})}}{c{\rm (H{{L}^{2-}})}}={{10}^{-11.6}}$,$\rm B$正确;
$\rm C$.曲线$\rm IV$和曲线$\rm V$得交点代表,$\rm {{\delta}_{{{\left[ CuL \right]}^{-}}}}={{\delta}_{{{\left[ Cu{{L}_{2}} \right]}^{4-}}}}$,即$c{\rm ({{\left[ Cu{{L}_{2}} \right]}^{4-}})}=c{\rm ({{\left[ CuL \right]}^{-}})}$,此时$\lg c{\rm ({{L}^{3-}})}=-7.2$,可得$\rm {{L}^{3-}}+{{\left[ CuL \right]}^{-}}\rightleftharpoons {{\left[ Cu{{L}_{2}} \right]}^{4-}}$的平衡常数${{K}_{2}}=\dfrac{c{\rm ({{\left[ Cu{{L}_{2}} \right]}^{4-}})}}{c{\rm ({{L}^{3-}})}\cdot c{\rm ({{\left[ CuL \right]}^{-}})}}=\dfrac{1}{{{10}^{-7.2}}}={{10}^{7.2}}$,$\rm a$点时,$\rm {{\delta}_{C{{u}^{2+}}}}={{\delta}_{{{\left[ Cu{{L}_{2}} \right]}^{4-}}}}$,带入${{K}_{1}}\times {{K}_{2}}=\dfrac{c{\rm ({{\left[ CuL \right]}^{-}})}}{c{\rm ({{L}^{3-}})}\cdot c{\rm (C{{u}^{2+}})}}\times \dfrac{c{\rm ({{\left[ Cu{{L}_{2}} \right]}^{4-}})}}{c{\rm ({{L}^{3-}})}\cdot c{\rm ({{\left[ CuL \right]}^{-}})}}=\dfrac{1}{{{c}^{2}}({{\rm L}^{3-}})}={{10}^{9.4}}\times {{10}^{7.2}}={{10}^{16.6}}$,解得$c{\rm ({{L}^{3-}})}={{10}^{-8.3}}\rm \ mol/L$,且$\rm a$点对应$c{\rm (H{{L}^{2-}})}=0.1\rm \ mol/L$,带入$\rm H{{L}^{2-}}\rightleftharpoons {{H}^{+}}+{{L}^{3-}}$的平衡常数$K=\dfrac{c{\rm ({{L}^{3-}})}\cdot c{\rm ({{\operatorname{H}}^{+}})}}{c{\rm (H{{L}^{2-}})}}={{10}^{-11.6}}$,计算得$c{\rm ({{H}^{+}})}={{10}^{-4.3}}\rm \ mol/L$,故$\rm pH=4.3$,$\rm C$错误;
$\rm D$.当$\rm pH=6.4$时,$c{\rm (H{{L}^{2-}})}$最大,接近$\rm {{10}^{-1}}\rm \ mol/L$,结合$\rm B$项中平衡常数可计算得$c{\rm ({{L}^{3-}})}\approx {{10}^{-6.2}}\rm \ mol/L$,$\rm {{\delta}_{{{\left[ Cu{{L}_{2}} \right]}^{4-}}}}=0.90$,$\rm {{\delta}_{{{\left[ CuL \right]}^{-}}}}=0.09$结合$\rm Cu$ 元素守恒知,$c{\rm ({{\left[ Cu{{L}_{2}} \right]}^{4-}})}=0.90\times 0.002 \ \rm mol/L=1.8\times {{10}^{-3}}\ mol/L$,$c{\rm ({{\left[ CuL \right]}^{-}})}=0.09\times 0.002 \ \rm mol/L=1.8\times {{10}^{-4}}\ mol/L$,因此体系中$c{\rm (H{{L}^{2-}})}\gt c{\rm ({{\left[ Cu{{L}_{2}} \right]}^{4-}})}\gt c{\rm ({{\left[ CuL \right]}^{-}})}\gt c{\rm ({{L}^{3-}})}$,$\rm D$正确;
故选:$\rm C$
| 化学平衡常数题目答案及解析(完整版)
