| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
生产生物柴油过程中,会产生大量副产物甘油$\left( {{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}} \right)$,利用甘油制${{\text{H}}_{2}}$是一种有经济价值的研究途径。回答下列问题:
甘油水蒸气重整法制${{\text{H}}_{2}}$主要发生如下反应($\text{C}{{\text{H}}_{4}}$为反应过程中的副产物):
反应$\rm 1$:${{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}}\left( \text{g} \right)=3\text{CO}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta{ H}=+340\;\rm \text{kJ}/\text{mol}$
反应$\rm 2$:$\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta{ H}=-41\;\rm \text{kJ}/\text{mol}$
反应$\rm 3$:$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta{ H}=+165\;\rm \text{kJ}/\text{mol}$
$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)=\text{CO}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)$的$\Delta{ H}=$ $\;\rm \text{kJ}/\text{mol}$。反应$\rm 1$能够自发进行的条件是 (选填“高温”“低温”或“任意温度”)。
$\\rm +206$; 高温
"]]根据盖斯定律,反应$\rm 3-$反应$\rm 2$可得该反应,故$\Delta{ H}=\left( +165\;\rm \text{kJ}/\text{mol} \right)-\left( -4\text{1\ kJ}/\text{mol} \right)=+206\;\rm \text{kJ}/\text{mol}$;
反应$\rm 1$的$\Delta{ H}\gt 0$,$\Delta{ S}\gt 0$,温度较高时$\Delta{ G}\lt 0$有利于自发进行;
初始投料$\dfrac{{n}\left( {{\text{H}}_{2}}\text{O} \right)}{{n}\left( {{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}} \right)}=\dfrac{9}{1}$,甘油水蒸气重整法制${{\text{H}}_{2}}$各物质的平衡物质的量分数随温度变化如图所示。
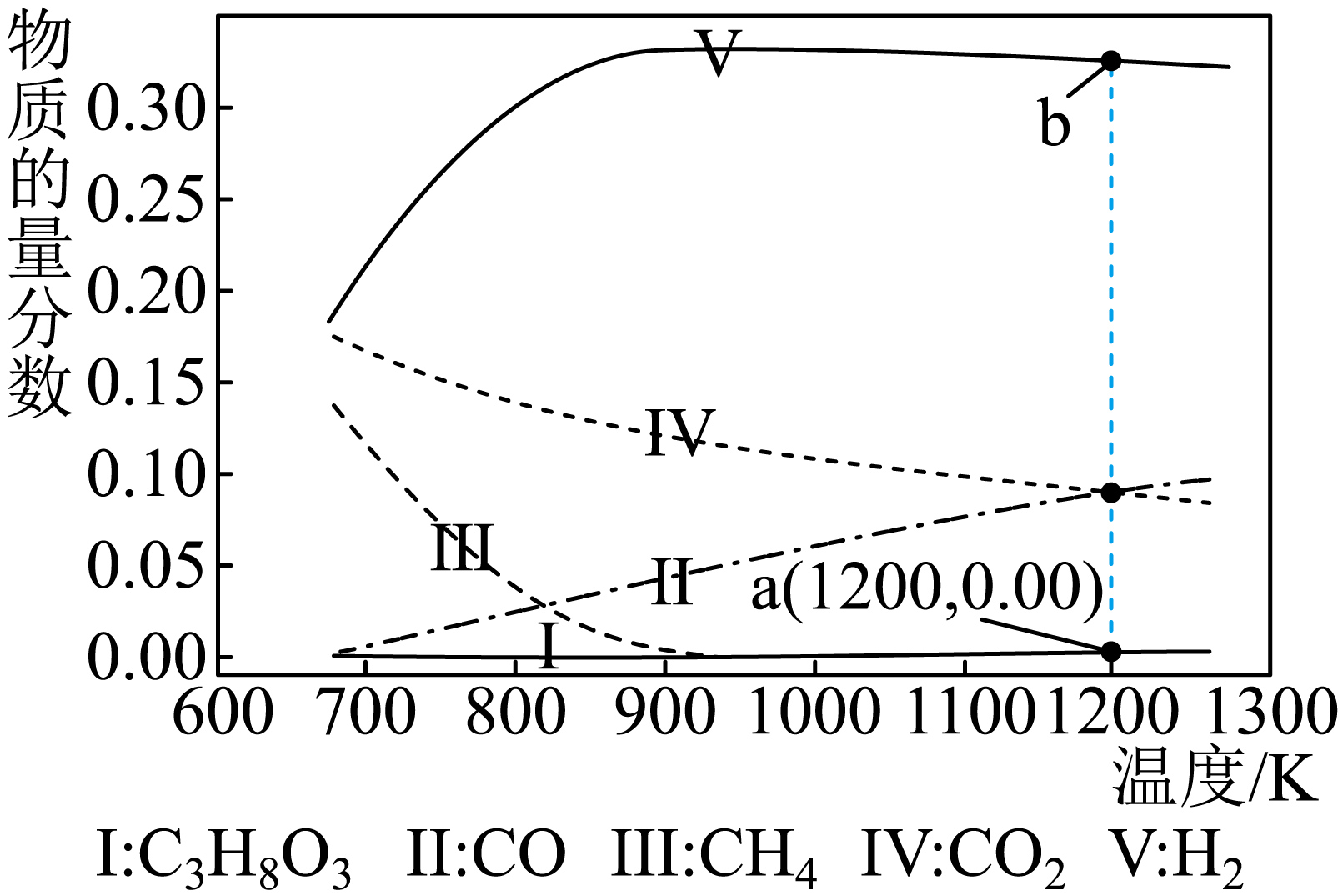
①温度为$\rm 1000\ K$时,${{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}}\left( \text{g} \right)$的平衡转化率最接近 。
$\rm A$.$\rm 10\%$ $\rm B$.$\rm 40\%$ $\rm C$.$\rm 50\%$ $\rm D$.$\rm 100\%$
②温度高于$\rm 923\ K$后,${{\text{H}}_{2}}$的物质的量分数会降低,主要由 (填“反应$\rm 1$”“反应$\rm 2$”或“反应$\rm 3$”)的平衡 (填“正向”或“逆向”)移动造成。
③图中$\rm b$点的纵坐标数据为 (小数点后保留$\rm 2$位),温度为$\rm 1200\ K$时反应$\rm 2$的压强平衡常数${{{K}}_{\text{p}}}=$ (小数点后保留$\rm 2$位)。
$\\rm D$ ;反应$\\rm 2$ ;逆向; $\\rm 0.34$ ;$\\rm 0.72$
"]]①观察图中数据,温度为$\rm 1000\ K$时,${{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}}\left( \text{g} \right)$的物质的量分数为$\rm 0$,故${{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}}\left( \text{g} \right)$完全反应,平衡转化率为$\rm 100\%$;
②反应$\rm 1$和反应$\rm 3$均为吸热反应,升温有利于反应正向进行,反应$\rm 2$为放热反应,达到平衡后,升温会导致平衡逆向移动,从而使氢气的物质的量分数降低;
③假设初始${{\text{H}}_{2}}\text{O}$的物质的量为$\rm 9\;\rm mol$,${{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}}$的物质的量为$\rm 1\;\rm mol$。由图中数据可知温度为$\rm 1200\ K$时,${{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}}$和$\text{C}{{\text{H}}_{4}}$的平衡物质的量为$\rm 0$,体系中存在的物质为$\text{C}{{\text{O}}_{2}}\text{CO}{{\text{H}}_{2}}{{\text{H}}_{2}}\text{O}$。设$\text{C}{{\text{O}}_{2}}$和$\rm CO$物质的量均为$n$,${{\text{H}}_{2}}$的物质的量为$x$,${{\text{H}}_{2}}\text{O}$的物质的量为$y$,根据原子守恒可建立如下关系:
$2{n}=3\;\rm \text{mol}\rm ($根据$\rm C$守恒$\rm )$
$3{n}+{y}=12\;\rm \text{mol}\rm ($根据$\rm O$守恒$\rm )$
$2{x}+2{y}=26\;\rm \text{mol}\rm ($根据$\rm H$守恒$\rm )$
解得${n}=1.5\; \text{mol}\ \ \ {x}=5.5\; \text{mol}\quad {y}=7.5\;\rm \text{mol}$
$n_{总}=1.5\;\rm mol+1.5\;\rm mol+5.5\;\rm mol+7.5\;\rm mol=16\;\rm mol$,$\text{C}{{\text{O}}_{2}}、\text{CO}、{{\text{H}}_{2}}、{{\text{H}}_{2}}\text{O}$的物质的量分数近似值分别为:$\rm 0.09$、$\rm 0.09$、$\rm 0.34$、$\rm 0.47$。
设$\rm 1200\ K$时体系的总压为$p$,${{{K}}_{\text{p}}}=\dfrac{{p}\left( \text{C}{{\text{O}}_{2}} \right)\times {p}\left( {{\text{H}}_{2}} \right)}{{p}\left( \text{CO} \right)\times {p}\left( {{\text{H}}_{2}}\text{O} \right)}=\dfrac{\left( {p}\times 0.09 \right)\times \left( {p}\times 0.34 \right)}{\left( {p}\times 0.09 \right)\times \left( {p}\times 0.47 \right)}=0.72$;
利用甘油$\rm —$水蒸气氧化法也可制氢气:$4{{\text{C}}_{3}}{{\text{H}}_{8}}{{\text{O}}_{3}}\left( \text{g} \right)+6{{\text{H}}_{2}}\text{O}\left( \text{g} \right)+3{{\text{O}}_{2}}\rightleftharpoons 12\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+22{{\text{H}}_{2}}\left( \text{g} \right)$反应过程中加入一定的生石灰,可提高${{\text{H}}_{2}}$的产率,其原因是 。
$\\rm CaO$与$\\text{C}{{\\text{O}}_{2}}$发生反应导致平衡正向移动
"]]$\rm CaO$与$\text{C}{{\text{O}}_{2}}$发生反应,使$\text{C}{{\text{O}}_{2}}$的浓度降低,促使平衡正向移动,从而提高${{\text{H}}_{2}}$的产率。
| 化学平衡常数题目答案及解析(完整版)
