| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
乙二醇$\rm (EG)$是一种重要的基础化工原料,可通过石油化工和煤化工等工业路线合成。
石油化工路线中,环氧乙烷$\rm (EO)$水合工艺是一种成熟的乙二醇生产方法,环氧乙烷和水反应生成乙二醇,伴随生成二乙二醇$\rm (DEG)$的副反应。
主反应:${\rm EO(aq)+{{H}_{2}}O(l)=EG(aq)}\quad\Delta H\lt 0$
副反应:$\rm EO(aq)+EG(aq)=DEG(aq)$
体系中环氧乙烷初始浓度为$\rm 1.5\ mol\cdot {{L}^{-1}}$,恒温下反应$\rm 30\ min$,环氧乙烷完全转化,产物中$n{\rm (EG)}:n{\rm (DEG)}=10:1$。
①$\rm 0\sim 30\ min$内,${{v}_{总}}\rm (EO)=$ $\rm mol\cdot {{L}^{-1}}\cdot mi{{n}^{-1}}$。
②下列说法正确的是 $\rm ($填序号$\rm )$。
$\rm a$.主反应中,生成物总能量高于反应物总能量
$\rm b$.$\rm 0\sim 30\ min$内,${{v}_{总}}{\rm (EO)}={{v}_{总}}\rm (EG)$
$\rm c$.$\rm 0\sim 30\ min$内,${{v}_{主}}{\rm (EG)}:{{v}_{副}}\rm (DEG)=11:1$
$\rm d$.选择适当催化剂可提高乙二醇的最终产率
$\\rm 0.05\\ mol\\cdot {{L}^{-1}}\\cdot mi{{n}^{-1}}$ ;$\\rm cd$
"]]①$\rm 0\sim 30\ min$内,环氧乙烷完全转化,${{v}_{总}}{\rm (EO)}=\dfrac{\Delta {{c}_{总}}\rm (EO)}{\Delta t}=\rm \dfrac{1.5\ mol\cdot {{L}^{-1}}}{30\ \min }=0.05\ mol\cdot {{L}^{-1}}\cdot mi{{n}^{-1}}$;
②$\rm a$.$\Delta H=生成物总能量-反应物总能量$,主反应中,$\Delta H\lt 0$,则生成物总能量低于反应物总能量,$\rm a$错误;
$\rm b$.由题中信息可知主反应伴随副反应发生,$\rm EG$作为主反应的生成物同时也是副反应的反应物,即$\rm EG$浓度的变化量小于$\rm EO$浓度的变化量,$\rm 0\sim 30\ min$内,$ {{v}_{总}}{\rm (EO)}\gt {{v}_{总}}\rm (EG)$,$\rm b$错误;
$\rm c$.主反应中,${{v}_{主}}{\rm (EG)}={{v}_{主}}\rm (EO)$,副反应${{v}_{副}}{\rm (EG)}={{v}_{副}}\rm (DEG)$,同一反应体系中物质一量变化量之比等于浓度变化量之比,产物中$n{\rm (EG)}:n{\rm (DEG)}=10:1$,即$c{\rm (EG)}:c{\rm (DEG)}=10:1$,${{v}_{总}}{\rm (EG)}={{v}_{主}}{\rm (EG)}-{{v}_{副}}\rm (EG)$,反应时间相同,则${{v}_{总}}{\rm (EG)}:{{v}_{副}}\rm (DEG)=10:1$,$\dfrac{{{v}_{主}}{\rm (EG)}-{{v}_{副}}\rm (EG)}{{{v}_{副}}\rm (DEG)}=10:1$,则${{v}_{主}}{\rm (EG)}:{{v}_{副}}\rm (DEG)=11:1$,$\rm c$正确;
$\rm d$.选择适当催化剂可提高主反应的选择性,可提高 乙二醇的最终产率,$\rm d$正确。
煤化工路线中,利用合成气直接合成乙二醇,原子利用率可达$\rm 100\%$,具有广阔的发展前景。反应如下:${\rm 2CO(g)+3{{H}_{2}}(g)\rightleftharpoons HOC{{H}_{2}}C{{H}_{2}}OH(g)}\quad\Delta H$。按化学计量比进料,固定平衡转化率$\rm \alpha $,探究温度与压强的关系。$\rm \alpha $分别为$\rm 0.4$、$\rm 0.5$和$\rm 0.6$时,温度与压强的关系如图:
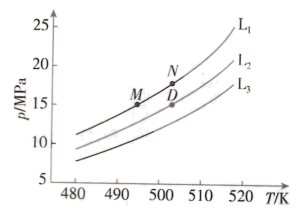
①代表$\rm \alpha=0.6$的曲线为 $\rm ($填“$\rm {{L}_{1}}$”“$\rm {{L}_{2}}$”或“$\rm {{L}_{3}}$”$\rm )$;原因是 。
②$\Delta H$ $\rm 0($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
③已知:反应$ a{\rm A(g)}+b{\rm B(g)}\rightleftharpoons y{\rm Y(g)}+z\rm Z(g)$,${{K}_{x}}=\dfrac{{{x}^{y}}{\rm (Y)}{{x}^{z}}\rm (Z)}{{{x}^{a}}({\rm A}){{x}^{b}}\rm (B)}$,$x$为组分的物质的量分数。$\rm M$、$\rm N$两点对应的体系,${{K}_{x}}\rm (M)$ ${{K}_{x}}\rm (N)($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$,$\rm D$点对应体系的${{K}_{x}}$的值为 。
④已知:反应$a{\rm A(g)}+b{\rm B(g)}\rightleftharpoons y{\rm Y(g)}+z\rm Z(g)$,${{K}_{\rm p}}=\dfrac{{{p}^{y}}{\rm (Y)}{{p}^{z}}\rm (Z)}{{{p}^{a}}({\rm A}){{p}^{b}}(\rm B)}$,$p$为组分的分压。调整进料比为$n{\rm (CO)}:n{\rm ({{H}_{2}})}=m:3$,系统压强维持${p}_0 \ \rm {MPa}$,使$\rm \alpha({{H}_{2}})=0.75$,此时$ {{K}_{\rm p}}=$ $\rm MP{{a}^{-4}}($用含有$m$和$ {{p}_{0}}$的代数式表示$\rm )$。
$\\rm {{L}_{1}}$; 该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大 ;$\\rm \\lt $ ;$\\rm =$; $\\rm 12$; $\\dfrac{1}{{{(\\dfrac{m-1.5}{m}{{p}_{0}}\\ {\\rm MPa})}^{2}}{{(\\dfrac{0.75}{m}{{p}_{0}}\\ \\rm MPa)}^{2}}}$
"]]①${\rm 2CO(g)+3{{H}_{2}}(g)\rightleftharpoons HOC{{H}_{2}}C{{H}_{2}}OH(g)}\quad\Delta H$该反应为气体体积减小的反应,温度相同时,增大压强,平衡正向移动,平衡转化率增大,$p{\rm ({{L}_{1}})}\gt p{\rm ({{L}_{2}})}\gt p{\rm ({{L}_{3}})}$,故$\rm {{L}_{1}}$、$\rm {{L}_{2}}$、$\rm {{L}_{3}}$对应$\rm \alpha$为$\rm 0.6$、$\rm 0.5$、$\rm 0.4$;
②由图可知,压强相同时,温度升高,平衡转化率减小,说明升高温度平衡逆向移动,则正反应为放热反应,$\Delta H\lt 0$;
③$\rm M$、$\rm N$的进料相同,平衡转化率相等,平衡时各组分物质的量分数分别相等,则${{K}_{x}}({\rm M})={{K}_{x}}\rm (N)$;$\rm D$点对应的平衡转化率为$\rm 0.5$,根据题中信息,该反应按化学计量比进料,设起始加入$\rm 2\ mol\ CO$和$\rm 3\ mol\ H_{2}$,列三段式:$\rm \begin{matrix} {} & \rm 2CO(g) & + & \rm 3{{H}_{2}}(g) & \rightleftharpoons & \rm HOC{{H}_{2}}C{{H}_{2}}OH(g) \\ 起始\rm (mol) & 2 & {} & 3 & {} & 0 \\ 转化\rm (mol) & 1 & {} & 1.5 & {} & 0.5 \\ 平衡\rm (mol) & 1 & {} & 1.5 & {} & 0.5 \\ \end{matrix}$,平衡时,$\rm CO$、$\rm {{H}_{2}}$、$\rm HOC{{H}_{2}}C{{H}_{2}}OH$的物质的量分数分别为$\rm \dfrac{1}{3}$、$\dfrac{1}{2}$、$\dfrac{1}{6}$,${{K}_{x}}=\dfrac{\dfrac{1}{6}}{{{(\dfrac{1}{2})}^{3}}{{(\dfrac{1}{3})}^{2}}}=12$;
④设起始加入$m\ \rm mol\ CO$和$\rm 3\ mol\ H_{2}$,此时$\rm \alpha({{H}_{2}})=0.75$,列三段式:$\rm \begin{matrix} {} & \rm 2CO(g) & + & \rm 3{{H}_{2}}(g) & \rightleftharpoons &\rm HOC{{H}_{2}}C{{H}_{2}}OH(g) \\ 起始\rm (mol) & m & {} & 3 & {} & 0 \\ 转化\rm (mol) & 1.5 & {} & 2.25 & {} & 0.75 \\ 平衡\rm (mol) & m-1.5 & {} & 0.75 & {} & 0.75 \\ \end{matrix}$,平衡时,气体总的物质的量为$m\ \rm mol$,$\rm CO$、$\rm {{H}_{2}}$、$\rm HOC{{H}_{2}}C{{H}_{2}}OH$平衡分压分别${p}_0 {\ \rm MPa}$,${{K}_{\rm p}}=\dfrac{\dfrac{0.75}{m}{{p}_{0}}\ \rm MPa}{{{(\dfrac{m-1.5}{m}{{p}_{0}}\ {\rm MPa})}^{2}}{{(\dfrac{0.75}{m}{{p}_{0}}\ {\rm MPa})}^{3}}}=\dfrac{1}{{{(\dfrac{m-1.5}{m}{{p}_{0}}\ {\rm MPa})}^{2}}{{(\dfrac{0.75}{m}{{p}_{0}}\ \rm MPa)}^{2}}}\ \rm MP{{a}^{-4}}$。
| 化学平衡常数题目答案及解析(完整版)
