| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
工业烟气中$\text{N}{{\text{O}}_{x}}\rm ($以$\text{NO}$为主$\rm )$的脱除常采用$\text{N}{{\text{H}}_{\text{3}}}$选择性催化还原$\rm (SCR)$技术,其核心反应为:主反应:$\text{4N}{{\text{H}}_{\text{3}}}\text{(g)}+\text{4NO(g)}+{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{4}{{\text{N}}_{\text{2}}}\text{(g)+6}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta {{H}_{1}}$
副反应:$\text{4N}{{\text{H}}_{\text{3}}}\text{(g)}+\text{5}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{4NO(g)}+\text{6}{{\text{H}}_{\text{2}}}\text{O(g)}\quad \Delta {{H}_{\text{2}}}\text{=-905}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
已知${{\text{N}}_{\text{2}}}\text{(g)}+{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{2NO(g)}\quad \Delta {{H}_{3}}=\text{+131}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,则$\Delta {{H}_{1}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
$\\rm -1429$
"]]根据盖斯定律可知,$\Delta {{H}_{3}}=\dfrac{\Delta {{H}_{2}}-\Delta {{H}_{1}}}{4}=\dfrac{-905\ \text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}-\Delta {{H}_{1}}}{4}=+\text{131}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,解得$\Delta {{H}_{1}}=-\text{1429}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
$\rm 300^\circ C$时,在某恒温刚性容器中充入$[n\text{(N}{{\text{H}}_{\text{3}}}\text{)}+n\text{(NO) }\!\!]:n\text{(}{{\text{O}}_{\text{2}}}\text{)}=\text{4}:\text{1}$的混合气体,若仅发生主反应,下列叙述能说明反应已达到化学平衡状态的是 $\rm ($填字母$\rm )$。
$\rm a$.${{v}_{逆}}\text{(NO)}=4{{v}_{正}}\text{(}{{\text{O}}_{\text{2}}}\text{)}$
$\rm b$.混合气体的密度保持不变
$\rm c$.单位时间内断裂$\text{4 mol N-H}$键的同时断裂$\text{4 mol N}\equiv \text{N}$键
$\rm d$.${{\text{O}}_{\text{2}}}$的体积分数不再改变
$\\rm ad$
"]]$\rm a$.当${{v}_{逆}}\text{(NO)}=4{{v}_{正}}\text{(}{{\text{O}}_{\text{2}}}\text{)}$时,说明正反应速率等于逆反应速率,反应达到平衡状态,$\rm a$项正确;
$\rm b$.根据反应方程式可知,气体的质量不变,容器的容积不变,故密度不是变量,故当混合气体的密度保持不变时,不能说明反应达到了平衡状态,$\rm b$项错误;
$\rm c$.单位时间内断裂$\rm \text{12 mol N-H}$键的同时断裂$\rm \text{4 mol N}\equiv \text{N}$键,说明反应达到了平衡状态, $\rm c$项错误;
$\rm d$.反应达到平衡状态时,各组分的量不发生变化,故当$\rm {{\text{O}}_{\text{2}}}$的体积分数不再改变时,说明反应达到了平衡状态,$\rm d$项正确;
其他条件相同,在甲、乙两种催化剂作用下,若仅发生主反应,经过相同时间,$\text{NO}$转化率与温度的关系如图所示。
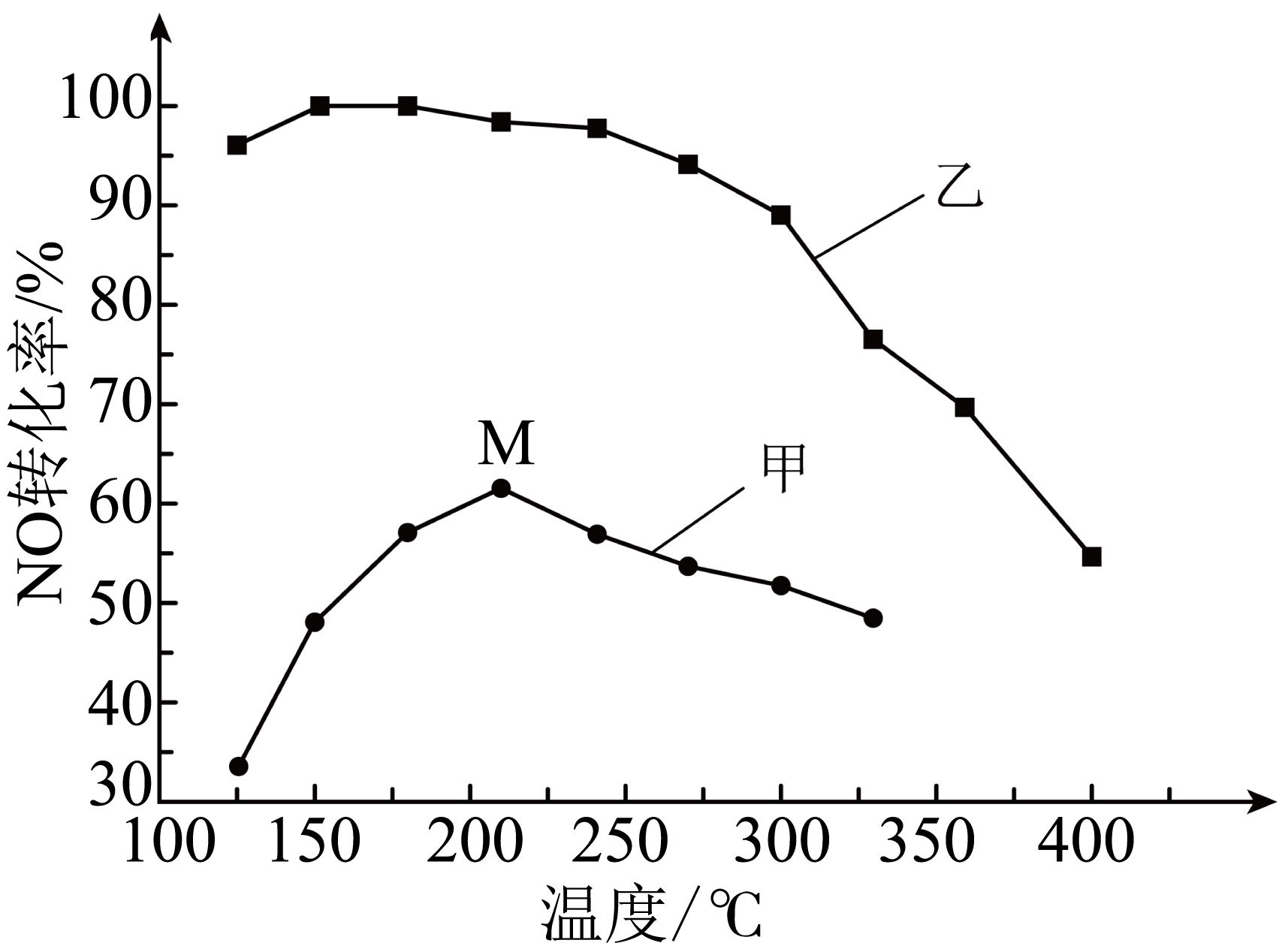
①工业上选择催化剂 $\rm ($填“甲”或“乙”$\rm )$。
②在催化剂甲的作用下,当温度高于$\text{210 }{}^\circ \text{C}\rm (M$点$\rm )$时,$\text{NO}$转化率降低原因可能是 。
乙 ; 催化剂活性降低或副反应增多
"]]①由图可知,催化剂乙在较低的温度下就具有较高的催化效果,故工业上选择催化剂乙;
②在催化剂甲的作用下,当温度高于$\rm 210\;\rm ^\circ\rm C$时,温度升高,催化剂活性降低,或者副反应增多,故导致$\rm NO$的转化率降低;
$300\text{ }{}^\circ \text{C}$时,在某恒压${{p}_{0}}$密闭容器中充入等物质的量的$\text{N}{{\text{H}}_{\text{3}}}$、$\text{NO}$、${{\text{O}}_{\text{2}}}$的混合气体,若仅发生主反应和副反应,平衡后,$\text{NO}$转化率为$20\%$,且$\text{N}{{\text{H}}_{3}}$和${{\text{N}}_{2}}$物质的量相等,则${{\text{N}}_{\text{2}}}\text{(g)}+{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{2NO(g)}\quad {{K}_{\text{p}}}=$ $\rm ($保留$\rm 2$位有效数字$\rm )$。
$\\rm 2.5$
"]]设在密闭容器中充入各$\rm 4$ $\rm mol$的$\text{N}{{\text{H}}_{\text{3}}}$、$\text{NO}$、${{\text{O}}_{\text{2}}}$的混合气体,根据三段式有
$\begin{matrix} {} & \text{4N}{{\text{H}}_{\text{3}}}\text{(g)} & + & \text{4NO(g)} & + & {{\text{O}}_{\text{2}}}\text{(g)} & \rightleftharpoons & \text{4}{{\text{N}}_{\text{2}}}\text{(g)} & + & \text{6}{{\text{H}}_{\text{2}}}\text{O(g)} \\起始 \text{/mol} & \text{4} & {} & \text{4} & {} & \text{4} & {} & \text{0} & {} & \text{0} \\转化 \text{/mol} & x & {} & x & {} & \dfrac{x}{4} & {} & x & {} & \dfrac{3x}{\text{2}} \\ 平衡\text{/mol} & 4-x & {} & 4-x & {} & 4-\dfrac{x}{4} & {} & x & {} & \dfrac{3x}{2} \\ \end{matrix}$
$\begin{matrix} {} & \text{4N}{{\text{H}}_{\text{3}}}\text{(g)} & + & \text{5}{{\text{O}}_{\text{2}}}\text{(g)} & \rightleftharpoons & \text{4NO(g)} & + & \text{6}{{\text{H}}_{\text{2}}}\text{O(g)} \\起始 \text{/mol} & 4-x & {} & 4-\dfrac{x}{4} & {} & 4-x & {} & \dfrac{3x}{2} \\转化 \text{/mol} & y & {} & \dfrac{5y}{4} & {} & y & {} & \dfrac{3y}{\text{2}} \\平衡 \text{/mol} & 4-x-y & {} & 4-\dfrac{x}{4}-\dfrac{5y}{4} & {} & 4-x+y & {} & \dfrac{3x}{2}+\dfrac{3y}{2} \\ \end{matrix}$,根据题意有
$\begin{cases} \dfrac{x-y}{4}=0.2 \\ 4-x-y=x \\ \end{cases}$,解得$\begin{cases} x=1.6\,\text{mol} \\ y=0.8\,\text{mol} \\ \end{cases}$,可知$P\text{(NO)=}\dfrac{\text{32}}{\text{126}}{{P}_{0}}$,$P\text{(}{{\text{N}}_{\text{2}}}\text{)=}\dfrac{\text{16}}{\text{126}}{{P}_{0}}$,$P\text{(}{{\text{O}}_{\text{2}}}\text{)=}\dfrac{\text{26}}{\text{126}}{{P}_{0}}$,反应${{\text{N}}_{\text{2}}}\text{(g)}+{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{2NO(g)}$的平衡常数${{K}_{\text{p}}}=\dfrac{{{P}^{\text{2}}}\text{(NO)}}{P\text{(}{{\text{N}}_{\text{2}}}\text{) }\times P\text{(}{{\text{O}}_{\text{2}}}\text{)}}=\dfrac{\dfrac{\text{32}}{\text{126}}{{P}_{\text{0}}}\cdot \dfrac{\text{32}}{\text{126}}{{P}_{\text{0}}}}{\dfrac{\text{16}}{\text{126}}{{P}_{\text{0}}}\cdot \dfrac{\text{26}}{\text{126}}{{P}_{\text{0}}}}=2.5$;
已知主反应分三步进行
$\rm I$.$\text{N}{{\text{H}}_{\text{3}}}\text{(g)}+\text{NO(g)}\to \text{N}{{\text{H}}_{\text{2}}}\text{NO(g)}+\text{H(g)}$
$\rm I$$\rm I$.$\text{N}{{\text{H}}_{\text{2}}}\text{NO(g)}\to {{\text{N}}_{\text{2}}}\text{(g)}+{{\text{H}}_{\text{2}}}\text{O(g)}$
$\rm II$$\rm I$.$\text{4H(g)}+{{\text{O}}_{\text{2}}}\text{(g)}\to \text{2}{{\text{H}}_{\text{2}}}\text{O(g)}$
研究发现,在催化剂表面引入$\text{Ce}{{\text{O}}_{\text{2}}}$可形成“$\text{N}{{\text{H}}_{\text{3}}}$吸附位”和“$\text{NO}$活化位”。
请分析催化剂表面引入$\text{Ce}{{\text{O}}_{\text{2}}}$后,主反应选择性提高、副反应选择性降低的原因是 。
定向活化$\\text{N}{{\\text{H}}_{\\text{3}}}$和$\\text{NO}$,同时减少了$\\text{N}{{\\text{H}}_{\\text{3}}}$和${{\\text{O}}_{\\text{2}}}$的碰撞,促进了主反应的发生,抑制副反应对${{\\text{O}}_{\\text{2}}}$的竞争
"]]在催化剂表面引入$\text{Ce}{{\text{O}}_{\text{2}}}$可形成“$\text{N}{{\text{H}}_{\text{3}}}$吸附位”和“$\text{NO}$活化位”,即催化剂表面引入$\text{Ce}{{\text{O}}_{\text{2}}}$后,可定向活化$\text{N}{{\text{H}}_{\text{3}}}$和$\text{NO}$,同时减少了$\text{N}{{\text{H}}_{\text{3}}}$和${{\text{O}}_{\text{2}}}$的碰撞,促进了主反应的发生,同时抑制副反应对${{\text{O}}_{\text{2}}}$的竞争。
| 化学平衡常数题目答案及解析(完整版)
