| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
合成氨是人类科学技术的重大突破,我国目前氨的生产能力位居世界首位。
已知合成氨反应中每生成$\rm 17\ g \ N{{H}_{3}}(g)$,放出$\rm 46.07$ $\rm kJ$热量,请写出合成氨的热化学方程式 。
${\\rm {{N}_{2}}(g)+3{{H}_{2}}(g)\\rightleftharpoons 2N{{H}_{3}}(g)}\\quad\\Delta H=-92.14\\rm \\ kJ/mol$
"]]合成氨反应中每生成$\rm 17\ g \ N{{H}_{3}}(g)$即$\rm 1\ mol$,放出$\rm 46.07$ $\rm kJ$热量,合成氨的热化学方程式${\rm {{N}_{2}}(g)+3{{H}_{2}}(g)\rightleftharpoons 2N{{H}_{3}}(g)}\quad\Delta H=-92.14\rm \ kJ/mol$;
关于合成氨工艺的理解,下列正确的是$\rm (\quad\ \ \ \ )$。
$\rm A$.合成氨工业中,为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化
$\rm B$.根据勒夏特列原理,合成氨宜采用$\rm 400\sim 500\ ^\circ \text{C}$高温
$\rm C$.及时补充$\rm {{N}_{2}}$和$\rm {{H}_{2}}$,使反应物保持一定浓度,有利于合成氨的反应
$\rm D$.恒温恒容条件下,等物质的量的$\rm {{N}_{2}}$和$\rm {{H}_{2}}$投入装置内反应,当$\rm {{N}_{2}}$的体积分数不变时,可以判断反应达到平衡状态
$\\rm AC$
"]]$\rm A$.合成氨工业中,原料气必须经过净化,防止混有的杂质使催化剂“中毒”,$\rm A$正确;
$\rm B$.高温虽然反应速率加快,但合成氨的反应为放热反应,高温平衡逆移,产率减小,$\rm B$错误;
$\rm C$.及时补充$\rm {{N}_{2}}$和$\rm {{H}_{2}}$,增大反应物浓度,平衡正移,有利于合成氨的反应,$\rm C$正确;
$\rm D$.恒温恒容条件下,等物质的量的$\rm {{N}_{2}}$和$\rm {{H}_{2}}$投入装置内反应,氮气的体积分数为定值$\rm 50\%$,当$\rm {{N}_{2}}$的体积分数不变时,不可以判断反应达到平衡状态,$\rm D$错误。
为了显著提高传统金属催化剂在温和条件下的合成氨性能,中科院大连化学物理研究所科研团队构筑了“过渡金属$\rm -LiH$”双活性中心催化体系,其反应过程分为以下三步(*表示催化剂的活性位点),据此写出②的化学方程式。
①$\rm {{N}_{2}}+2*=2N*$。
② 。
③$\rm [LiNH]+\dfrac{3}{2}{{H}_{2}}=LiH+N{{H}_{3}}$。
$\\rm N*+LiH=*+[LiNH]$
"]]设$\rm {{N}_{2}}(g)+3{{H}_{2}}(g)\rightleftharpoons 2N{{H}_{3}}(g)$为反应④,①$\rm {{N}_{2}}+2*=2N*$,③$\rm [LiNH]+\dfrac{3}{2}{{H}_{2}}=LiH+N{{H}_{3}}$,④$\rm -$③$\rm \times 2-$①得反应②$\rm N*+LiH=*+[LiNH]$;
$\rm N{{H}_{3}}$常用于烟气中的脱硝,反应如下:
反应$\rm I$.${\rm 4N{{H}_{3}}(g)+6NO(g)\rightleftharpoons 5{{N}_{2}}(g)+6{{H}_{2}}O(g)}\quad\Delta {{H}_{1}}=-1838\rm \ kJ\cdot mo{{l}^{-1}}$
反应Ⅱ.${\rm 4N{{H}_{3}}(g)+4NO(g)+{{O}_{2}}(g)\rightleftharpoons 4{{N}_{2}}(g)+6{{H}_{2}}O(g)}\quad\Delta {{H}_{2}}=-1657.5\rm \ kJ\cdot mo{{l}^{-1}}$
①某条件下对于反应$\rm I$,${{v}_{正}}={{k}_{正}}{{c}^{m}}{\rm (N{{H}_{3}})}{{c}^{n}}\rm (NO)$,${{v}_{逆}}={{k}_{逆}}{{c}^{p}}{\rm ({{N}_{2}})}{{c}^{q}}\rm ({{H}_{2}}O)$,${{k}_{正}}$、${{k}_{逆}}$为速率常数。升高温度时,${{k}_{正}}$增大$\rm a$倍,${{k}_{逆}}$增大$b$倍,则$a$ $b$(填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”)。
②当温度为$\rm 273\ ^\circ \text{C}$,在恒容密闭的容器中,发生上述两个反应。通入$\rm N{{H}_{3}}$、$\rm NO$、$\rm {{O}_{2}}$的物质的量比为$\rm 2:2:1$,初始压强为${{p}_{0}}$,达到平衡后测定$\rm NO$的逃逸率为$\rm 25.0$%($\rm NO$逃逸率$=\dfrac{剩余的n{\rm (NO)}}{初始的n{\rm (NO)}}\times 100\%$),$p{\rm ({{N}_{2}})}=0.28{{p}_{0}}$。则氨气的转化率为 $\%$(结果保留$\rm 3$位有效数字),反应$\rm I$的${{K}_{\rm p}}=$ (写出含${{p}_{0}}$的计算式即可)。
$\\rm \\lt $ ;$\\rm 65.0$; $ {{(0.28{{p}_{0}})}^{5}}\\cdot {{(0.39{{p}_{0}})}^{6}}/{{(0.14{{p}_{0}})}^{4}}\\cdot {{(0.1{{p}_{0}})}^{6}}$
"]]①$\dfrac{{{K}_{正}}}{{{K}_{逆}}}=K$,反应Ⅰ为放热反应,升高温度平衡逆向移动$ K$减小,故$a\lt b$;
②$\rm \begin{matrix} {} & \rm 4N{{H}_{3}}(g) & + & \rm 6NO(g) & \rightleftharpoons & \rm 5{{N}_{2}}(g) & + & \rm 6{{H}_{2}}O(g) \\ {{P}_{起始}} & \dfrac{2}{5}{{p}_{0}} & {} & \dfrac{2}{5}{{p}_{0}} & {} & 0 & {} & 0 \\ {{P}_{转化}} & 4x & {} & 6x & {} & 5x & {} & 6x \\ {{P}_{平衡}} & \dfrac{2}{5}{{p}_{0}}-4x & {} & \dfrac{2}{5}{{p}_{0}}-6x & {} & 5x & {} & 6x \\ \end{matrix}$
$\rm \begin{matrix} {} & \rm 4N{{H}_{3}}(g)+ & \rm 4NO(g)+ & \rm {{O}_{2}}(g) & \rightleftharpoons & \rm 4{{N}_{2}}(g) & + & 6{{H}_{2}}O(g) \\ {{P}_{起始}} & \dfrac{2}{5}{{p}_{0}}-4x & \dfrac{2}{5}{{p}_{0}}-6x & \dfrac{1}{5}{{p}_{0}} & {} & 5x & {} & 6x \\ {{P}_{转化}} & 4y & 4y & y & {} & 4y & {} & 6y \\ {{P}_{平衡}} & \dfrac{2}{5}{{p}_{0}}-4x-4y & \dfrac{2}{5}{{p}_{0}}-6x-4y & \dfrac{1}{5}{{p}_{0}}-y & {} & 5x+4y & {} & 6x+6y \\ \end{matrix}$
$p{\rm ({{N}_{2}})}=5x+4y=0.28{{p}_{0}}$,$\dfrac{\dfrac{2}{5}{{p}_{0}}-6x-4y}{\dfrac{2}{5}{{p}_{0}}}=25.0$,$x=0.02{{p}_{0}}$,$y=0.045{{p}_{0}}$,氨气的转化率为$\dfrac{0.26{{p}_{0}}}{\dfrac{2}{5}{{p}_{0}}}\times 100\%=65.0\%$;
${{K}_{\rm p}}=\dfrac{{{(0.28{{p}_{0}})}^{5}}\cdot {{(0.39{{p}_{0}})}^{6}}}{{{(0.14{{p}_{0}})}^{4}}\cdot {{(0.1{{p}_{0}})}^{6}}}$;
将一定比例的$\rm {{O}_{2}}$、$\rm N{{H}_{3}}$和$\rm NO$的混合气体匀速通入装有催化剂$\rm M$的反应器中,反应相同时间,$\rm NO$的去除率随反应温度的变化曲线如图所示。解释在$\rm 50\sim 150\ ^\circ \text{C}$范围内随温度升高,$\rm NO$的去除率迅速上升的主要原因是 。
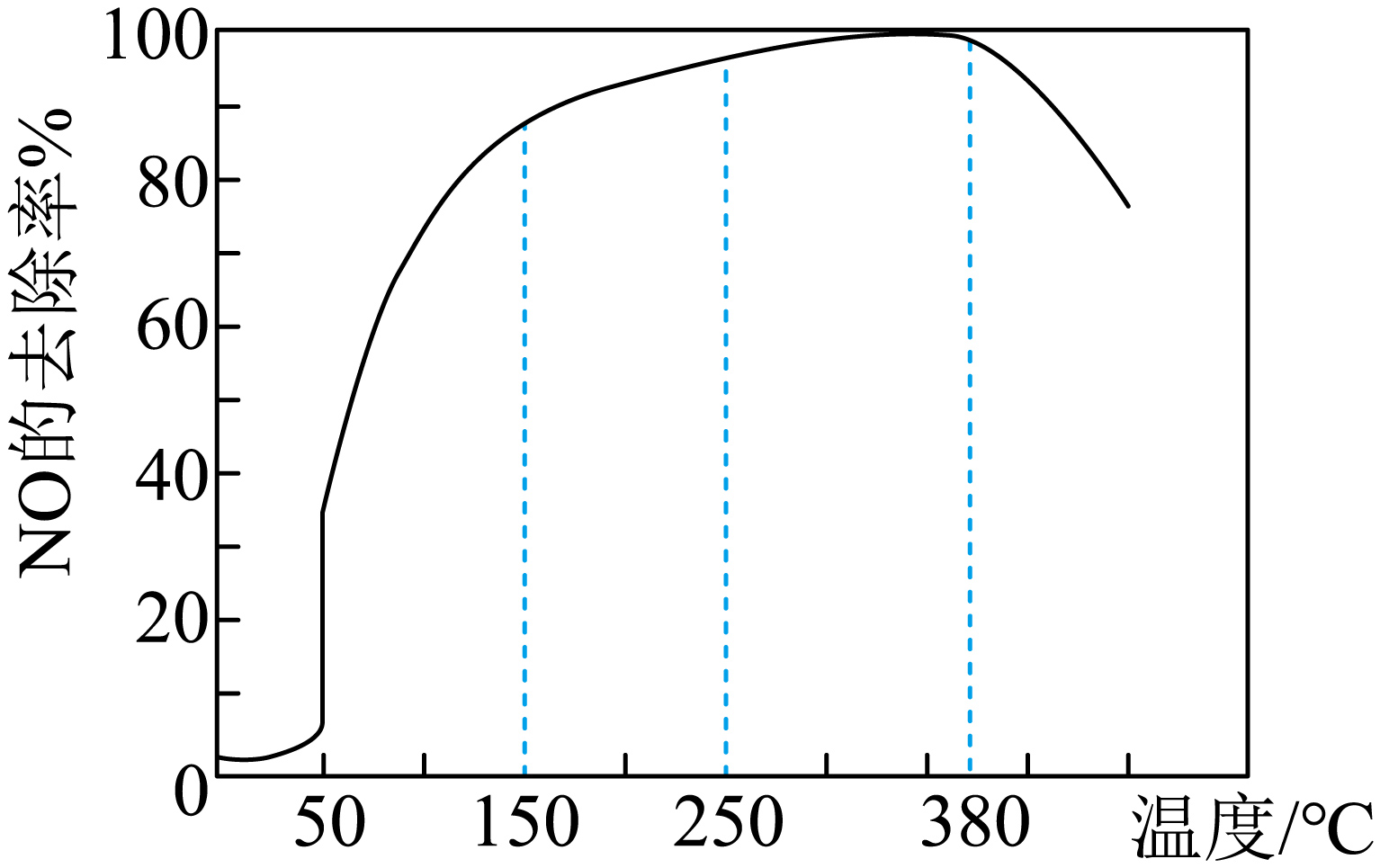
在$\\rm 50\\sim 150\\ ^\\circ \\text{C}$范围内,温度升高,反应速率加快(催化剂$\\rm M$活性随温度升高而增大,使$\\rm NO$去除反应速率迅速增大)(其他合理答案也可)
"]]在$\rm 50\sim 150\ ^\circ \text{C}$范围内,反应未达平衡,随温度升高,反应速率加快或催化剂$\rm M$活性随温度升高而增大,使$\rm NO$去除反应速率迅速增大。
| 化学平衡常数题目答案及解析(完整版)
