| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
含碳化合物的反应在化学工业中具有重要地位。回答下列问题;
甲酸$\left( \text{HCOOH} \right)$可分解产生氢气,相关热化学方程式如下;
Ⅰ.$\text{C}\left( \text{s} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-393.5\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
Ⅱ.$\text{C}\left( \text{s} \right)+{{\text{H}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=\text{HCOOH}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-378.7\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
Ⅲ.$\text{HCOOH}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{3}}$
$\Delta{{H}_{3}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
$\\rm -14.8$
"]]根据盖斯定律,反应$\rm I-$反应$\rm II=$反应$\rm III$,则$\Delta {{H}_{3}}=\Delta {{H}_{1}}-\Delta {{H}_{2}}=-393.5\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}+378.7\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=-14.8\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
在$T\text{ }{}^\circ \text{C}$时,向不同体积的恒容密闭容器中各加入$1\,\text{mol}\,\text{HCOOH}\left( \text{g} \right)$,发生反应Ⅲ,反应相同时间,测得各容器中甲酸的转化率与容器体积的关系如图$\rm 1$,
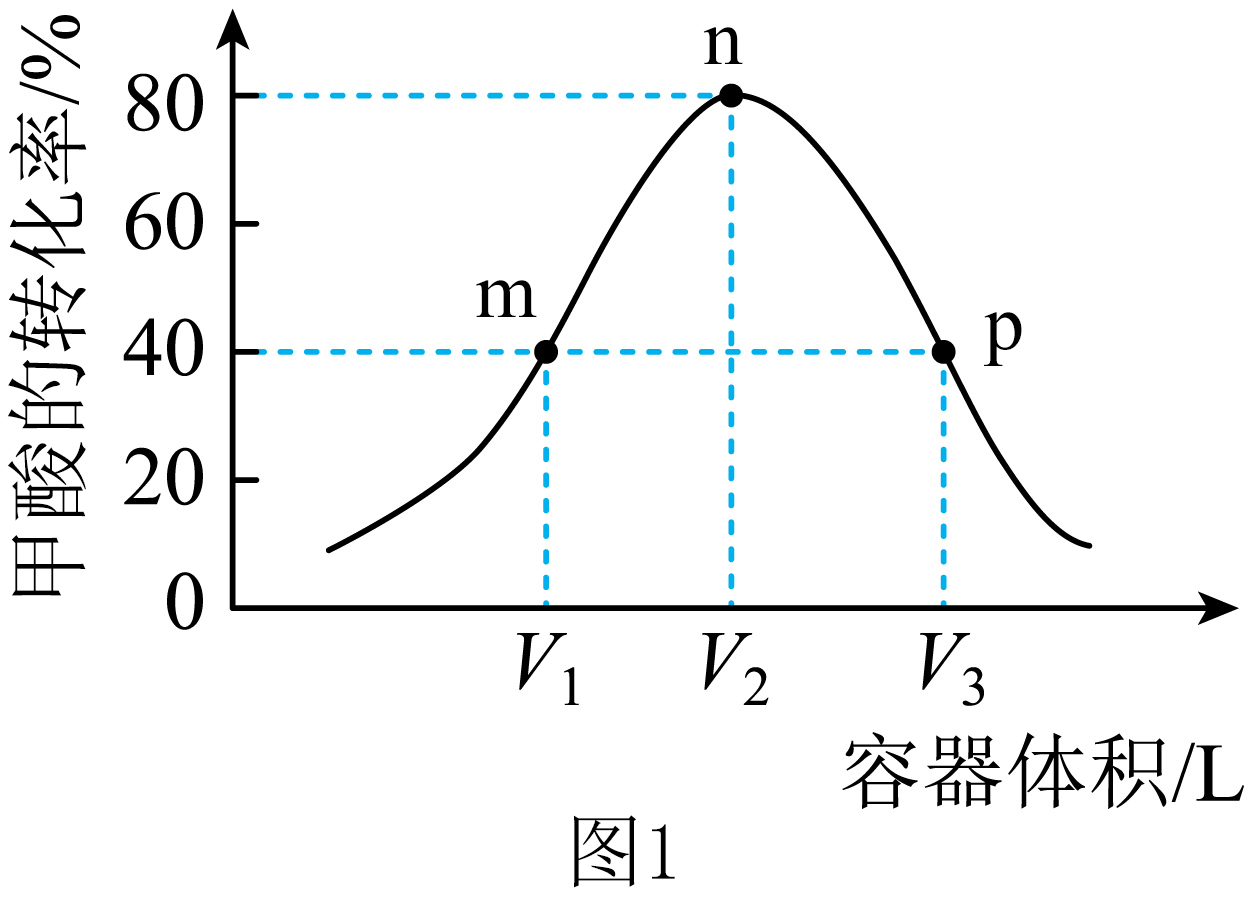
其中$\rm n$点反应达平衡。$\rm m$点时${{\text{H}}_{2}}$的体积分数为 $\rm ($结果保留$\rm 2$位有效数字$\rm )$;$\text{m},\text{p}$两点中,甲酸的浓度;$\rm m$ $\rm p($填“$\rm \gt $”,“$\rm \lt $”或“$\rm =$”$\rm )$;该温度下该反应的平衡常数$K=$ $\rm ($用含“${{V}_{1}}$”“${{V}_{2}}$”或“${{V}_{3}}$”的表达式表示$\rm )$;${{V}_{1}}:{{V}_{2}}=$ 。
$\\rm 29\\%$ ; $\\rm \\gt $ ; $\\dfrac{4}{15{{V}_{1}}}\\,\\text{mol}/\\text{L}$或$\\dfrac{16}{5{{V}_{2}}}\\,\\text{mol}/\\text{L}$ ; $\\rm 1$:$\\rm 12$
"]]起始时甲酸的物质的量为$\rm 1$ $\rm mol$,$\rm n$点反应达平衡,$\rm m$点甲酸的转化率为$\rm 40\%$,$\rm n$点甲酸的转化率为$\rm 80\%$,根据三段式:$\begin{matrix} {} & \text{HCOOH}\left( \text{g} \right) & \rightleftharpoons & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & +{{\text{H}}_{\text{2}}}\left( \text{g} \right) \\初始 \left( \text{mol} \right) & \text{1} & {} & \text{0} & \text{0} \\转化 \left( \text{mol} \right) & \text{0}\text{.4} & {} & \text{0}\text{.4} & \text{0}\text{.4} \\ \text{m点时}\left( \text{mol} \right) & \text{0}\text{.6} & {} & \text{0}{.4} & \text{0}\text{.4} \\ \end{matrix}$,则氢气的体积分数:$\dfrac{\text{0}{.4}}{\text{0}\text{.6+0}\text{.4+0}\text{.4}}\times 100\%\approx \text{29 }\!\!\%$;$\rm m$、$\rm p$两点甲酸的转化率相等,$\rm p$点容器体积更大,则平衡向体积减小方向移动,所以甲酸浓度:$\rm {m\gt p}$;$\begin{matrix} {} & \text{HCOOH}\left( \text{g} \right) & \rightleftharpoons & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & +{{\text{H}}_{\text{2}}}\left( \text{g} \right) \\初始 \left( \text{mol} \right) & \text{1} & {} & \text{0} & \text{0} \\ 转化\left( \text{mol} \right) & \text{0}\text{.8} & {} & \text{0}\text{.8} & \text{0}\text{.8} \\ \text{n点平衡时}\left( \text{mol} \right) & \text{0}\text{.2} & {} & \text{0}\text{.8} & \text{0}\text{.8} \\ \end{matrix}$,该温度下该反应的平衡常数$K=\dfrac{\dfrac{0.8}{{{V}_{2}}}\times \dfrac{0.8}{{{V}_{_{2}}}}}{\dfrac{0.2}{{{V}_{2}}}}=\dfrac{16}{5{{V}_{2}}}\,\text{mol/L}\rm (m$点时$\rm HCOOH(g)$、$\rm CO_{2}(g)$、$\rm H_{2}(g)$的物质的量分别为$\rm 0.6$ $\rm mol$、$\rm 0.4$ $\rm mol$、$\rm 0.4$ $\rm mol$,其浓度分别$\dfrac{0.6}{{{V}_{1}}}\ \text{mol/L}$、$\dfrac{\text{0}\text{.4}}{{{V}_{\text{1}}}}\ \text{mol/L}$、$\dfrac{\text{0}\text{.4}}{{{V}_{\text{1}}}}\ \text{mol/L}$,平衡常数$K=\dfrac{\dfrac{0.4}{{{V}_{1}}}\times \dfrac{0.4}{{{V}_{1}}}}{\dfrac{0.6}{{{V}_{1}}}}=\dfrac{4}{15{{V}_{1}}}\ \text{mol}/\text{L}\rm )$;相同温度下,平衡常数相等,则$\dfrac{16}{5{{V}_{2}}}=\dfrac{4}{15{{V}_{1}}}$,即${{V}_{1}}:{{V}_{2}}=1:12$;
工业上常用氯苯$\left( {{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl} \right)$和硫化氢$\left( {{\text{H}}_{2}}\text{S} \right)$在特定催化剂条件下反应来制备苯硫酚$\left( {{\text{C}}_{6}}{{\text{H}}_{5}}-\text{SH} \right)$,但会有副产物苯$\left( {{\text{C}}_{6}}{{\text{H}}_{6}} \right)$生成。
Ⅳ.${{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl}\left( \text{g} \right)+{{\text{H}}_{2}}\text{S}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{6}}{{\text{H}}_{5}}-\text{SH}\left( \text{g} \right)+\text{HCl}\left( \text{g} \right)\quad \Delta {{H}_{4}}=-16.8\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
Ⅴ$ .{{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl}\left( \text{g} \right)+{{\text{H}}_{2}}\text{S}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{6}}{{\text{H}}_{6}}\left( \text{g} \right)+\text{HCl}\left( \text{g} \right)+\dfrac{1}{8}{{\text{S}}_{8}}\left( \text{g} \right)\quad \Delta {{H}_{5}}=-45.8\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
①将体积比$1:1$的${{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl}$和${{\text{H}}_{2}}\text{S}$的混合气体通过含有催化剂的不同温度下的恒温反应器,定时测定反应器尾端出来的混合气体中各产物的量,得到单程收率与温度的关系如图$\rm 2.$
$\text{单程收率}[=\dfrac{原料一次性通过反应器后得到的产品{{\text{C}}_{6}}{{\text{H}}_{5}}-\text{SH}\left( 或{{\text{C}}_{6}}{{\text{H}}_{6}} \right)的物质的量}{起始{{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl}的物质的量}\times 100\%]$
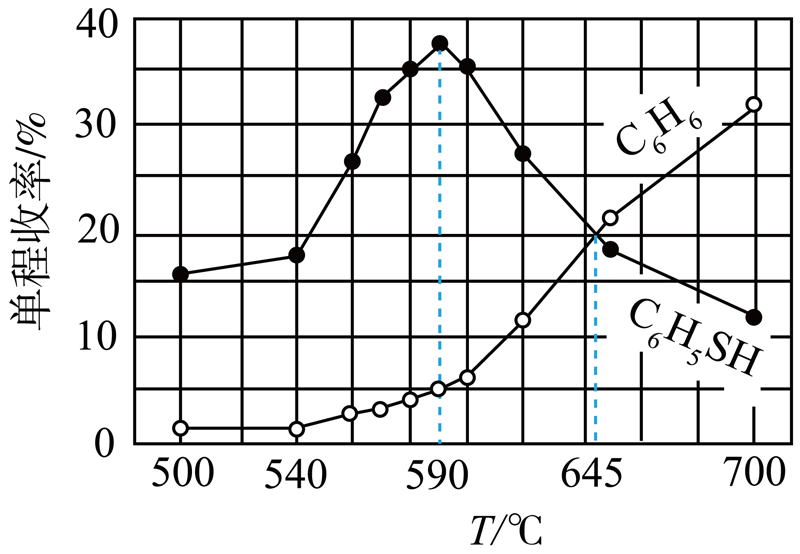 图$\rm 2$
图$\rm 2$
下列说法正确的是 。
$\rm a$.$\rm 645\;\rm ^\circ\rm C$时,反应Ⅳ的化学平衡常数$K=\dfrac{2}{9}$
$\rm b$.$\rm 590\;\rm ^\circ\rm C$以上,随温度升高,反应Ⅳ平衡逆向移动
$\rm c$.$\rm 645\;\rm ^\circ\rm C$,延长反应时间,可以提高${{\text{C}}_{6}}{{\text{H}}_{6}}$的单程收率
②现将一定量的${{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl}$和${{\text{H}}_{2}}\text{S}$置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应$\rm 20$ $\rm min$测定生成物的浓度。实验测得温度较低时${{\text{C}}_{6}}{{\text{H}}_{5}}-\text{SH}$浓度大于${{\text{C}}_{6}}{{\text{H}}_{6}}$,从活化能角度分析其主要原因是 。
$\\rm abc$ ; 反应Ⅳ的活化能小于反应Ⅴ的活化能,反应Ⅳ的反应速率快于反应Ⅴ,相同时间内获得的产物的浓度反应Ⅳ比反应Ⅴ多
"]]①$\rm a$.体积比$1:1$的${{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl}$和${{\text{H}}_{2}}\text{S}$即物质的量之比也为$1:1$,设投放各$\rm 1$ $\rm mol$,列三段式:$\begin{matrix} {} & {{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl}\left( \text{g} \right) & + & {{\text{H}}_{2}}\text{S}\left( \text{g} \right) & \rightleftharpoons & {{\text{C}}_{6}}{{\text{H}}_{5}}-\text{SH}\left( \text{g} \right) & + & \text{HCl}\left( \text{g} \right) \\起始 \left( \text{mol} \right) & 1 & {} & 1 & {} & 0 & {} & 0 \\转化 \left( \text{mol} \right) & 0.2 & {} & 0.2 & {} & 0.2 & {} & 0.2 \\平衡 \left( \text{mol} \right) & 0.6 & {} & 0.6 & {} & 0.2 & {} & 0.4 \\ \end{matrix}$,$\begin{matrix} {} & {{\text{C}}_{6}}{{\text{H}}_{5}}-\text{Cl}\left( \text{g} \right) & + & {{\text{H}}_{2}}\text{S}\left( \text{g} \right) & \rightleftharpoons & {{\text{C}}_{6}}{{\text{H}}_{6}}\left( \text{g} \right) & + & \text{HCl}\left( \text{g} \right) & + & \dfrac{1}{8}{{\text{S}}_{8}}\left( \text{g} \right) \\ 起始\left( \text{mol} \right) & 1 & {} & 1 & {} & 0 & {} & 0 & {} & 0 \\转化 \left( \text{mol} \right) & 0.2 & {} & 0.2 & {} & 0.2 & {} & 0.2 & {} & 0.025 \\平衡 \left( \text{mol} \right) & 0.6 & {} & 0.6 & {} & 0.2 & {} & 0.4 & {} & 0.025 \\ \end{matrix}$,反应Ⅳ的化学平衡常数$K=\dfrac{c\left( {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{5}}}\text{-SH} \right)c\left( \text{HCl} \right)}{c\left( {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{5}}}\text{-Cl} \right)c\left( {{\text{H}}_{\text{2}}}\text{S} \right)}=\dfrac{\dfrac{0.4}{V}\dfrac{0.2}{V}}{\dfrac{0.6}{V}\dfrac{0.6}{V}}=\dfrac{2}{9}$,$\rm a$正确;
$\rm b$.$\rm 590\;\rm ^\circ\rm C$以上,随温度升高,反应Ⅳ为放热反应,平衡逆向移动,$\rm b$正确;
$\rm c$.反应$V$是一个放热反应,$\rm C_{6}H_{6}$单程收率一直上升,说明还没有达到平衡,延长反应时间是可以提高$\rm C_{6}H_{6}$的单程收率的,$\rm c$正确;
故选:$\rm abc$;
②$\rm C_{6}H_{5}-Cl$由反应Ⅴ生成,$\rm C_{6}H_{6}$由反应Ⅳ生成,图$\rm 1$显示温度较低时$\rm C_{6}H_{5}-Cl$浓度的增加程度大于$\rm C_{6}H_{6}$,说明反应Ⅳ的活化能小于反应Ⅴ的活化能,反应Ⅳ的反应速率快于反应Ⅴ,相同时间内获得的产物的浓度自然反应Ⅳ比反应Ⅴ多。
| 化学平衡常数题目答案及解析(完整版)
