| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
水煤气变换法反应为:$\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$,将各$\rm 0.5\;\rm mol$的$\rm CO$和${{\text{H}}_{2}}\text{O}$混合气体投入体积可变的密闭容器中,于不同的温度下测得反应物的物质的量分数$\rm (\varphi \rm )$随时间变化关系如图所示。
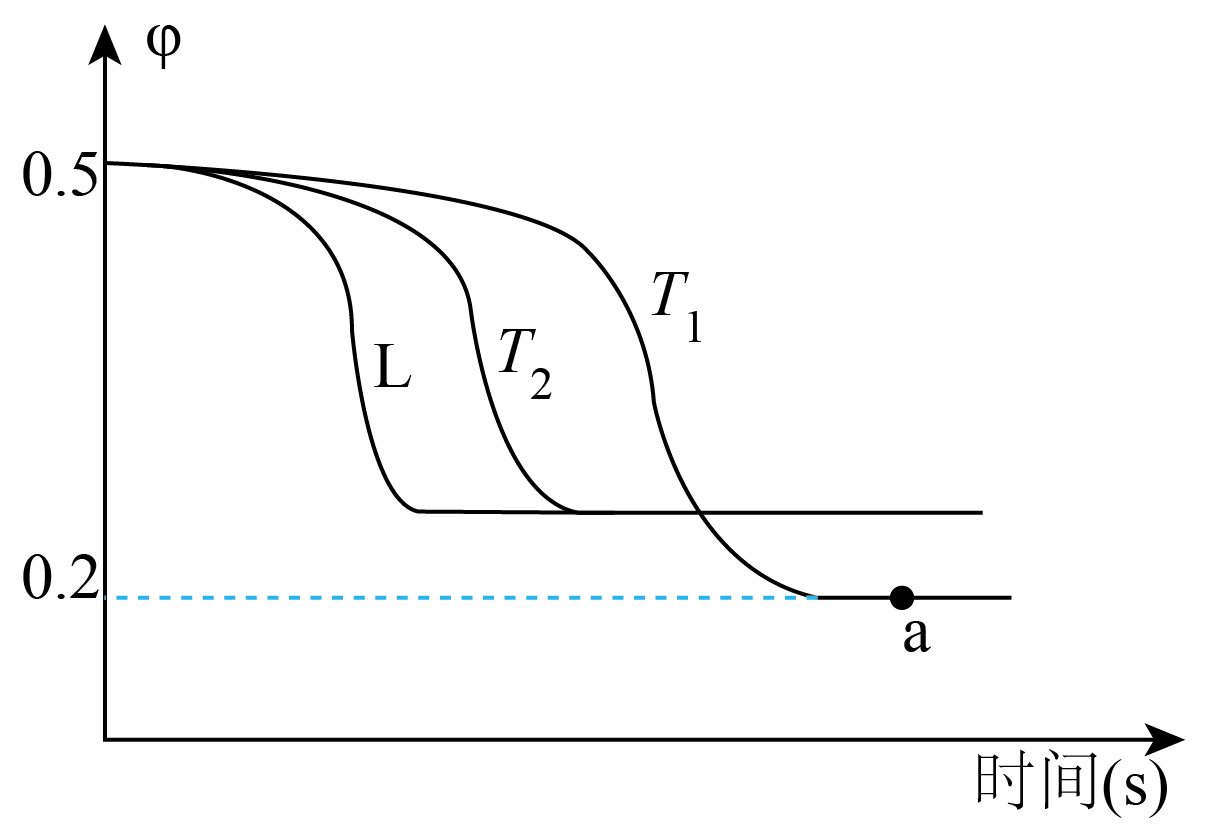
下列说法不正确的是$(\qquad)$
温度${{{T}}_{2}}$高于${{{T}}_{1}}$
","升高温度,正反应速率增大的倍数小于逆反应速率
","恒温恒容下,在状态$\\rm a$容器中再充入$\\rm 1.8\\;{mol\\;CO}$和$\\rm 2.7{\\;mol\\;C}{{{O}}_{2}}$,平衡不移动
","在${{{T}}_{2}}$时,反应物的物质的量投入加倍,则$\\varphi $随时间变化可能为曲线$\\rm L$
"]$\rm A$.由图可知,${{{T}}_{2}}$比${{{T}}_{1}}$先到达平衡状态,说明${{{T}}_{2}}$比${{{T}}_{1}}$对应反应速率快,则温度${{{T}}_{2}}\gt {{{T}}_{1}}$,$\rm A$正确;
$\rm B$.由图可知,升高温度,反应物的物质的量分数$\rm (\varphi \rm )$增大,说明升高温度平衡逆向移动,则正反应为放热反应;对放热反应而言,升高温度,正、逆反应速率都增大,但是正反应速率增大的倍数小于逆反应速率,$\rm B$正确;
$\rm C$.状态$\rm a$容器中,达到平衡时,消耗$\rm {CO}$、$\rm {{{H}}_{{2}}}{O}$物质的量均为$\rm 0.5\;\rm mol-0.2\;\rm mol=0.3\;\rm mol$,则生成$\rm {C}{{{O}}_{2}}$、$\rm {{{H}}_{2}}$物质的量均为$\rm 0.3\;\rm mol$,平衡时${K}=\dfrac{\dfrac{0.3\;\rm mol}{{V}}\times \dfrac{0.3\;\rm mol}{{V}}}{\dfrac{0.2\;\rm mol}{{V}}\times \dfrac{0.2\;\rm mol}{{V}}}=\dfrac{9}{4}$,再充入$\rm 1.8\;{mol\;CO}$和$\rm 2.7\;{mol\;C}{{{O}}_{2}}$,瞬时${Q}=\dfrac{\dfrac{3\;\rm mol}{{V}}\times \dfrac{0.3\;\rm mol}{{V}}}{\dfrac{2\;\rm mol}{{V}}\times \dfrac{0.2\;\rm mol}{{V}}}=\dfrac{9}{4}={K}$,则平衡不移动,$\rm C$正确;
$\rm D$.体积可变的密闭容器中,在${{{T}}_{2}}$时,反应物的物质的量投入加倍,则容器的体积也加倍,容器中反应物的浓度不变,化学反应速率不变,到达平衡的时间不变,则$\varphi $随时间变化不可能为曲线$\rm L$,$\rm D$错误。
故选:$\rm D$
| 化学平衡常数题目答案及解析(完整版)
