高中 | 导电的原因及条件 题目答案及解析
稿件来源:高途
高中 | 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
氨硼烷($\text{N}{{\text{H}}_{3}}\cdot \text{B}{{\text{H}}_{3}}$)电池可在常温下工作,装置如图。未加入氨硼烷之前,两电极室内液体质量相等,电池反应为$\text{N}{{\text{H}}_{3}}\cdot \text{B}{{\text{H}}_{3}}+3{{\text{H}}_{2}}{{\text{O}}_{2}}=\text{N}{{\text{H}}_{4}}\text{B}{{\text{O}}_{2}}+4{{\text{H}}_{2}}\text{O}$。已知${{\text{H}}_{2}}{{\text{O}}_{2}}$足量,下列说法不正确的是$(\qquad)$
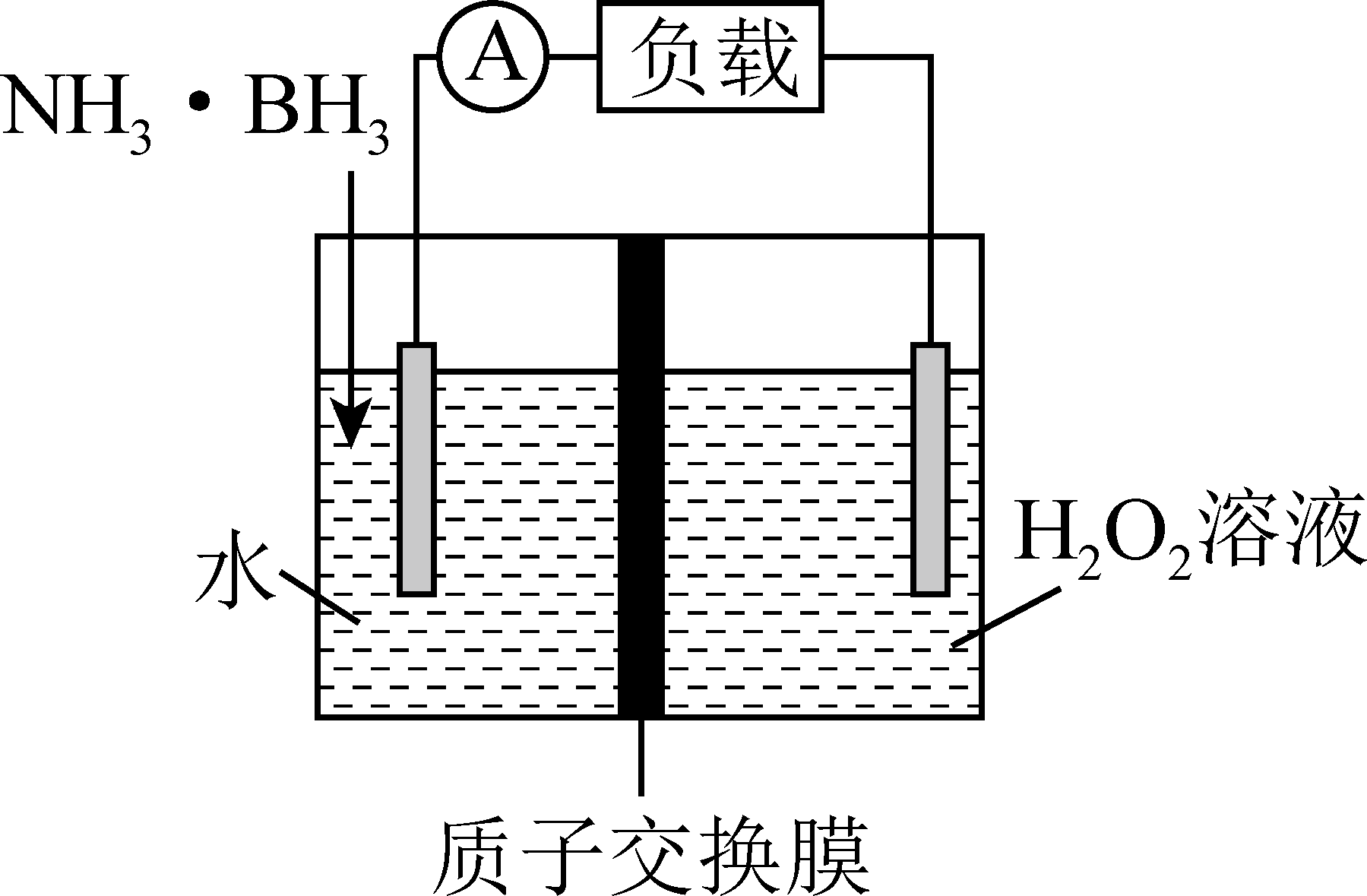
负极反应式为$\\text{N}{{\\text{H}}_{3}}\\cdot \\text{B}{{\\text{H}}_{3}}-6{{\\text{e}}^{-}}+2{{\\text{H}}_{2}}\\text{O}=\\text{NH}_{4}^{+}+\\text{BO}_{2}^{-}+6{{\\text{H}}^{+}}$
","电池工作时,${{\\text{H}}^{+}}$通过质子交换膜向正极移动
","其他条件不变,向酸性${{\\text{H}}_{2}}{{\\text{O}}_{2}}$溶液中加入适量硫酸能增强溶液导电性
","当消耗$6.2\\text{ g N}{{\\text{H}}_{3}}\\cdot \\text{B}{{\\text{H}}_{3}}$时,左右两极室内液体质量差为$5\\text{ g}$
"]由氨硼烷($\rm NH_{3}\cdot BH_{3}$)电池工作时的总反应$\rm NH_{3}\cdot BH_{3}+3H_{2}O_{2}= NH_{4}BO_{2}+4H_{2}O$可知,左侧通入$\rm NH_{3}\cdot BH_{3}$电极为负极,发生失电子的氧化反应,电极反应式为$\rm NH_{3}\cdot BH_{3}+2H_{2}O-6e^{-}=NH_{4}BO_{2}+6H^{+}$,右侧$\rm H_{2}O_{2}$所在电极为正极,发生得电子的还原反应,电极反应式为$\rm 3H_{2}O_{2}+6H^{+}+6e^{-}=6H_{2}O$。
$\rm A$.根据分析,负极反应式为$\rm NH_{3}\cdot BH_{3}+2H_{2}O-6e^{-}=NH_{4}BO_{2}+6H^{+}$,$\rm A$正确;
$\rm B$.电池内部阳离子向正极移动,右侧$\rm H_{2}O_{2}$所在电极为正极,因此电池工作时,$\rm H^{+}$通过质子交换膜向正极移动,$\rm B$正确;
$\rm C$.由于$\rm H_{2}SO_{4}$是强电解质,其他条件不变,向酸性$\rm H_{2}O_{2}$溶液中加入适量硫酸能增大溶液中自由移动离子的浓度,故能增强溶液导电性,$\rm C$正确;
$\rm D$.未加入氨硼烷之前,两极室室内液体质量相等,消耗$\rm 6.2\;\rm g\;\rm NH_{3}\cdot BH_{3}$后,根据负极电极反应$\rm NH_{3}\cdot BH_{3}+2H_{2}O-6e^{-}=NH_{4}BO_{2}+6H^{+}$可知,转移的电子的物质的量为$\rm 6\times \dfrac{\text{6}{.2\;\rm g}}{\text{31\;\rm g}/\text{mol}}\rm =1.2\;\rm mol$,此时有$\rm 1.2\;\rm mol\;\rm H^{+}$由左室进入右室,左室质量增加$\rm =6.2\;\rm g-1.2\;\rm g=5\;\rm g$,右室质量增加$\rm 1.2\;\rm g$,即两极质量相差$\rm 5\;\rm g-1.2\;\rm g=3.8\;\rm g$,$\rm D$错误;
故选:$\rm D$
高中 | 导电的原因及条件题目答案及解析(完整版)
