高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
利用电化学反应可以制备物质。
$\rm I$.将氢氧燃料电池应用于氯碱工业,其装置示意图如下:
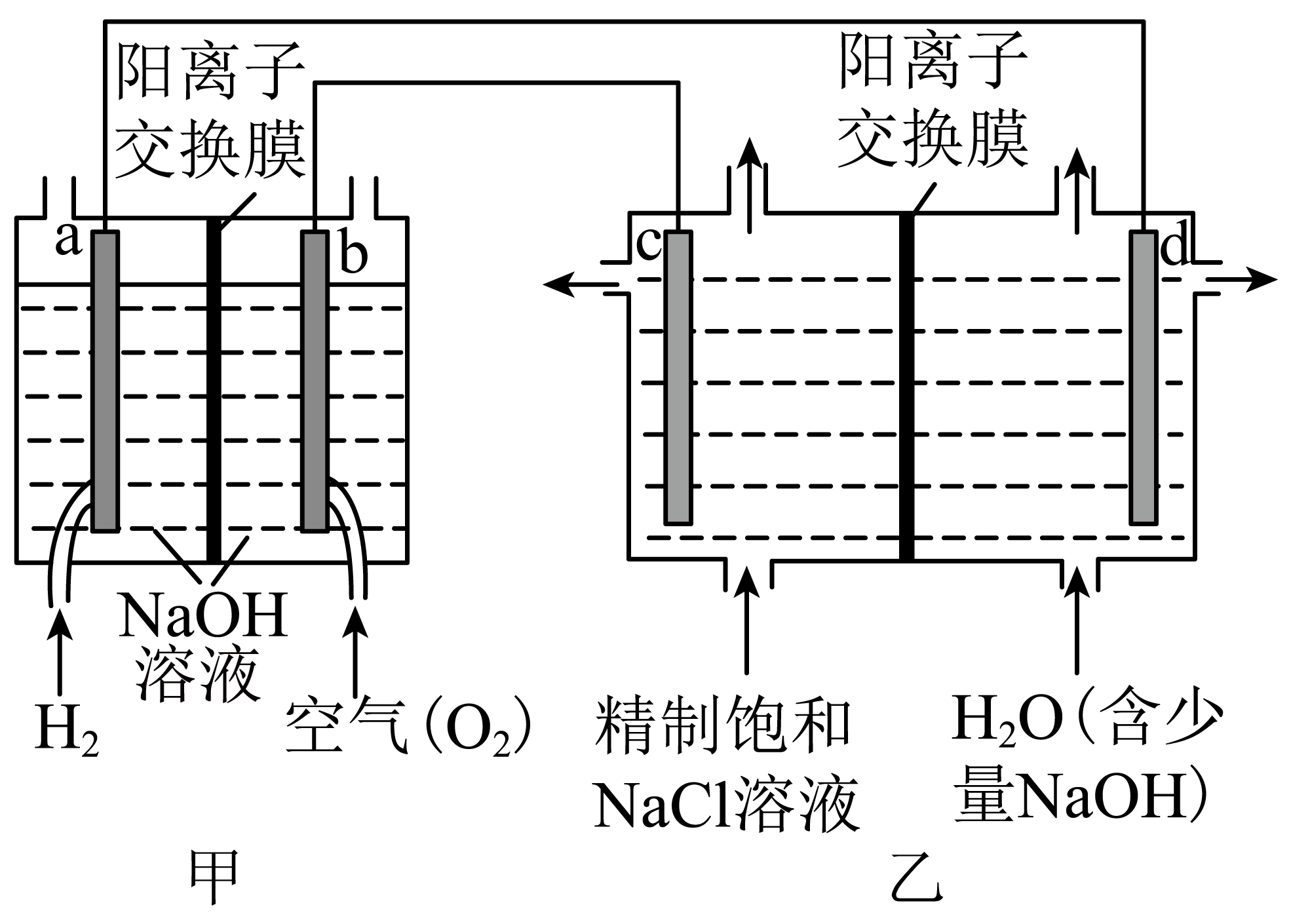
$\rm b$极的电极反应式为: 。
$\\rm {{O}_{2}}+4{{e}^{-}}+2{{H}_{2}}O=4O{{H}^{-}}$
"]]根据图示可知,甲为氢氧燃料电池,$\rm b$电极通入氧气,为正极,发生还原反应,在碱性电解质中生成氢氧根离子,$\rm b$极的电极反应式为:$\rm {{O}_{2}}+4{{e}^{-}}+2{{H}_{2}}O=4O{{H}^{-}}$。
写出氯碱工业原理的离子方程式: 。
$\\rm 2C{{l}^{-}}+2{{H}_{2}}O\\begin{matrix} \\underline{\\underline{电解}} \\\\ {} \\\\ \\end{matrix}2O{{H}^{-}}+{{H}_{2}}\\uparrow +C{{l}_{2}}\\uparrow $
"]]氯碱工业是电解饱和食盐水,生成氯气、氢气和烧碱的反应,氯碱工业的离子方程式为:$\rm 2C{{l}^{-}}+2{{H}_{2}}O\begin{matrix} \underline{\underline{电解}} \\ {} \\ \end{matrix}2O{{H}^{-}}+{{H}_{2}}\uparrow +C{{l}_{2}}\uparrow $。
下列关于乙装置说法中,正确的是 。
$\rm a$.在$\rm c$极区获得氯气
$\rm b$.在$\rm d$极区获得的产物,可供甲装置使用
$\rm c$.乙装置中$\rm N{{a}^{+}}$向$\rm c$极移动
$\\rm ab$
"]]$\rm a$.在$\rm c$极与原电池的正极相连,为电解池的阳极,发生氧化反应,获得氯气,$\rm a$正确。
$\rm b$.在$\rm d$极生成氢气逸出,溶液为氢氧化钠溶液,获得的产物,可供甲装置使用,$\rm b$正确。
$\rm c$.根据电性关系,乙装置中$\rm N{{a}^{+}}$向$\rm d$极移动,$\rm c$错误。
Ⅱ.工业上可采用惰性电极隔膜法电解$\rm {{K}_{2}}Mn{{O}_{4}}$溶液制备$\rm KMn{{O}_{4}}$,装置如下:
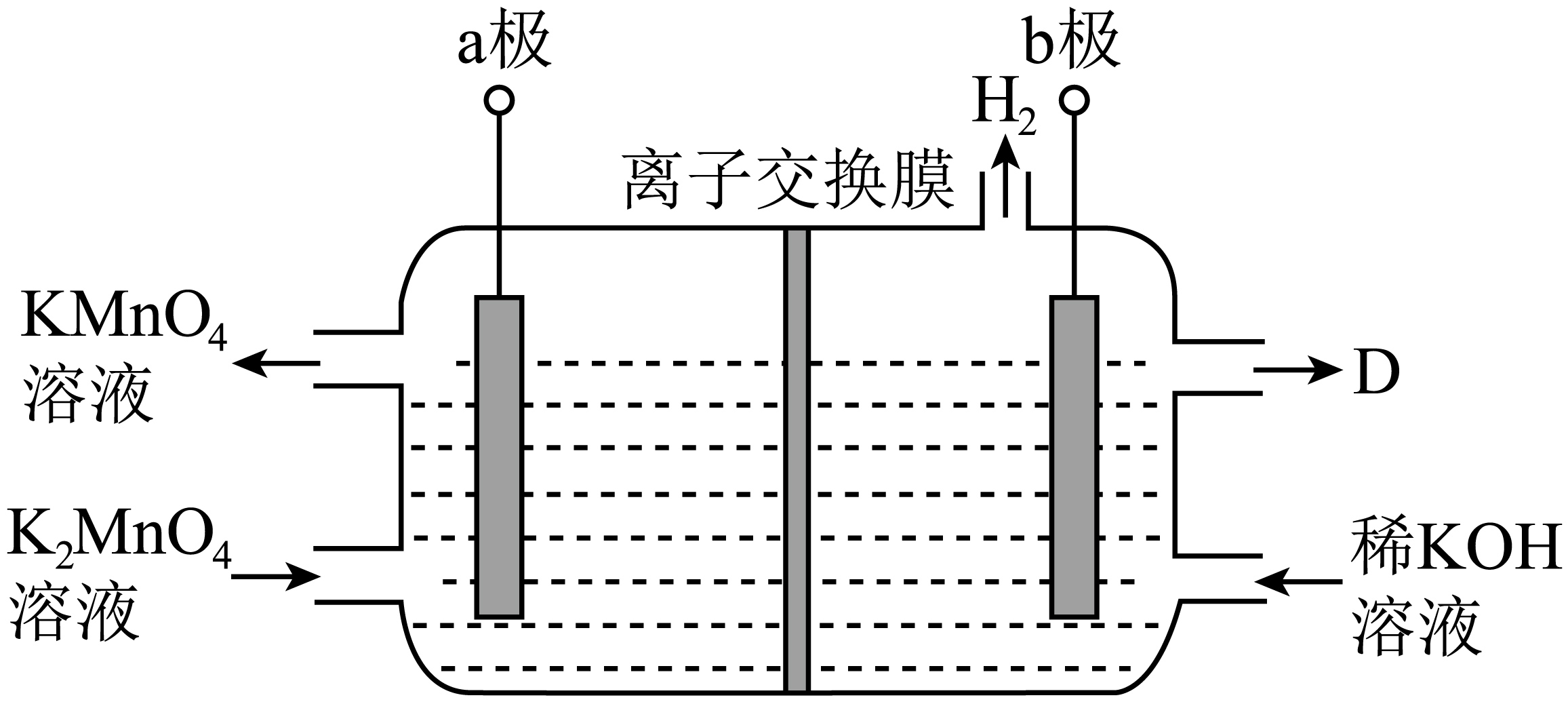
离子交换膜为 离子交换膜$\rm ($填“阴”或“阳”$\rm )$,$\rm D$是 。
阳;浓$\\rm KOH$溶液
"]]用惰性电极隔膜法电解$\rm {{K}_{2}}Mn{{O}_{4}}$溶液制备$\rm KMn{{O}_{4}}$装置中,$\rm a$极锰酸根失去电子被氧化成高锰酸根。$\rm a$极为阳极,$\rm b$极为阴极、生成氢气,溶液中生成氢氧根离子,根据电性作用,阳极区的钾离子要通过离子交换膜迁移到阴极区,故装置中的离子交换膜为阳离子交换膜;$\rm D$是浓$\rm KOH$溶液。
结合化学用语,简述该方法制备$\rm KMn{{O}_{4}}$的原理 。
阳极区发生反应$\\rm MnO_{4}^{2-}-{{e}^{-}}=MnO_{4}^{-}$,$c{\\rm (MnO_{4}^{-})}$增大;每产生$\\rm 1\\,mol\\ MnO_{4}^{-}$,就有$\\rm 1\\ mol\\ {{K}^{+}}$通过阳离子交换膜进入阴极区,使阳极区的$n{\\rm (MnO_{4}^{-})}:n{\\rm ({{K}^{+}})}=1:1$,制得$\\rm KMn{{O}_{4}}$
"]]阳极区发生反应$\rm MnO_{4}^{2-}-{{e}^{-}}=MnO_{4}^{-}$,$c{\rm (MnO_{4}^{-})}$增大;每产生$\rm 1\,mol\ MnO_{4}^{-}$,就有$\rm 1\ mol\ {{K}^{+}}$通过阳离子交换膜进入阴极区,使阳极区的$n{\rm (MnO_{4}^{-})}:n{\rm ({{K}^{+}})}=1:1$,制得$\rm KMn{{O}_{4}}$。
高中 | 原电池工作原理题目答案及解析(完整版)
