高中 | 化学平衡图像分析 题目答案及解析
稿件来源:高途
高中 | 化学平衡图像分析题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡图像分析
能量、速率与限度是认识和研究化学反应的重要视角。
Ⅰ.为了探究原电池的工作原理,设计如下装置。
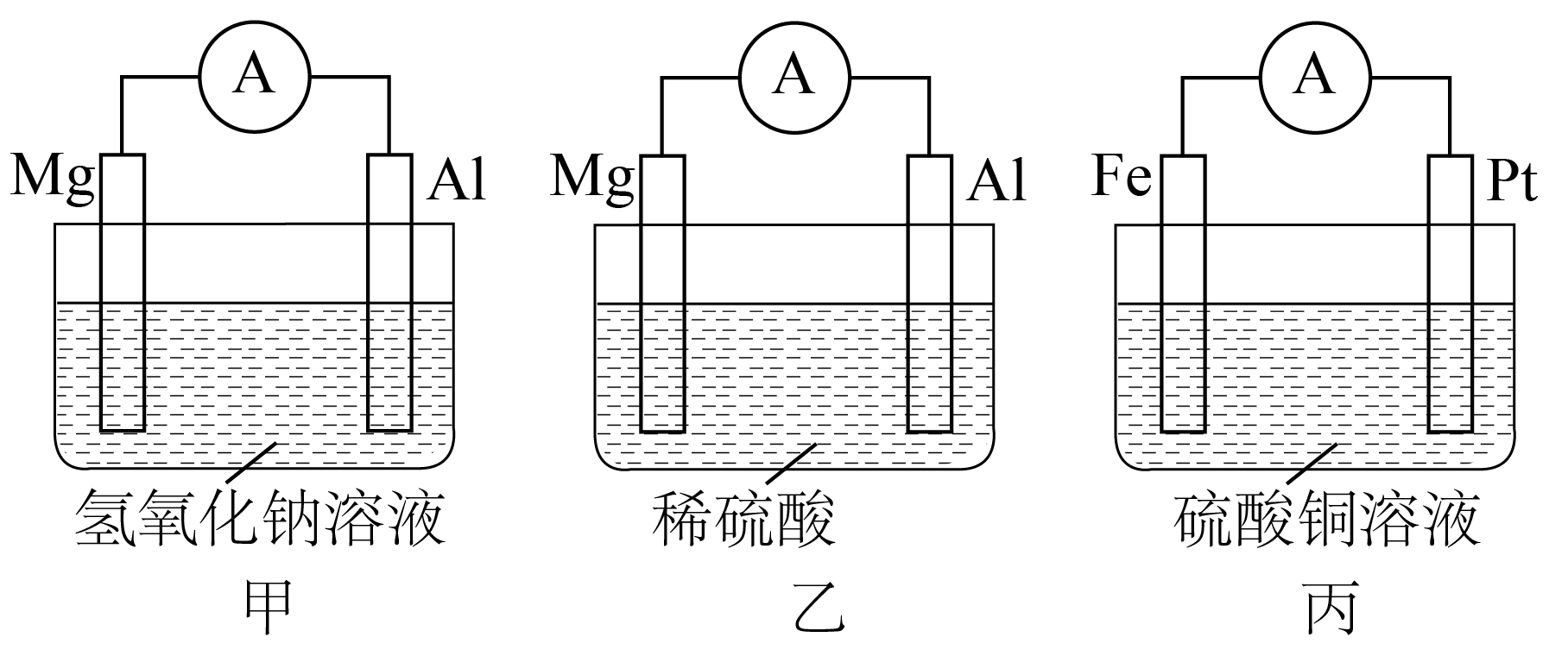
甲装置中负极电极反应式为 。
$\\rm {Al-3}{{{e}}^{-}}{+4O}{{{H}}^{-}}{=AlO}_{{2}}^{-}{+2}{{{H}}_{{2}}}{O}$
"]]甲装置中,$\rm Mg$与$\rm NaOH$不反应,$\rm Al$与$\rm NaOH$反应,因此$\rm Al$作负极,$\rm Al$失去电子发生氧化反应生成偏铝酸钠,电极反应式为$\rm {Al-3}{{{e}}^{-}}{+4O}{{{H}}^{-}}{=AlO}_{{2}}^{-}{+2}{{{H}}_{{2}}}{O}$;
当乙装置中的负极质量减少$1.8\text{ g}$时,正极产生气体 $\rm L($标准状况下$\rm )$;$\text{SO}_{4}^{2-}$向 $\rm ($填“$\text{Mg}$”或“$\text{Al}$”$\rm )$电极移动。
$\\rm 1.68$;$\\rm Mg$
"]]原电池中正极上发生还原反应。乙装置中总反应为镁和稀硫酸反应生成硫酸镁和氢气,$\rm Mg$为负极,发生反应$\rm Mg-2e^{-}=Mg^{2+}$,负极质量减少$\rm 1.8\;\rm g$时,失去的电子数为$\dfrac{1.8\text{ g}}{24\text{ g/mol}}\times 2\rm =0.15\;\rm mol$,$\rm Al$为正极,正极上氢离子得电子生成氢气,氢气的体积为$\dfrac{0.15\; \mathrm{mol}}{2}\rm \times 22.4\;\rm L/mol=1.68\;\rm L$;$\text{SO}_{4}^{2-}$向负极$\rm Mg$移动。
当丙装置中导线通过$\text{0} {.2\;\rm mol}$电子时,两电极质量相差 $\rm \;\rm g($放电前两电极质量相等$\rm )$。
$\\rm 12$
"]]乙装置中$\rm Fe$为负极,发生的反应为$\rm Fe-2e^{-}=Fe^{2+}$,$\rm Pt$为正极,发生的反应为$\rm Cu^{2+}+2e^{-}=Cu$,则转移$\rm 2\;\rm mol$电子时两极质量差为$\rm 64\;\rm g+56\;\rm g=120\;\rm g$,所以导线中转移$\rm 0.2\;\rm mol$电子时,两电极质量相差$\dfrac{ {120\;\rm g}}{ {2\;\rm mol}}\rm \times 0.2\;\rm mol=12\;\rm g$。
Ⅱ.${{\text{H}}_{2}}$、$\text{C}{{\text{H}}_{3}}\text{OH}$都是重要的能源物质,也是重要的化工原料。利用${{\text{H}}_{2}}$还原$\text{C}{{\text{O}}_{2}}$能有效促进“碳中和”,反应的化学方程式为$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})$。
反应过程中的能量变化如图所示:
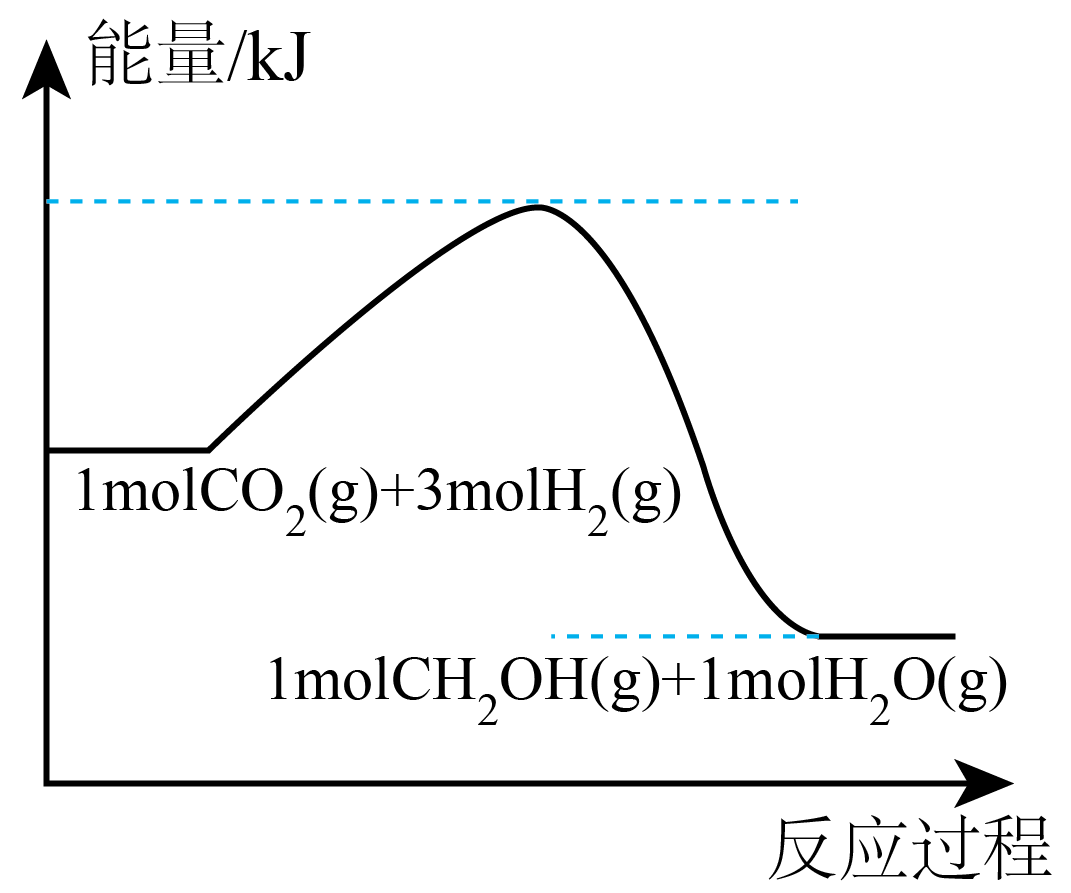
则该反应是 $\rm ($填“放热”或“吸热”$\rm )$反应。
放热
"]]图像中反应物的总能量大于生成物的总能量,故为放热反应。
$\rm 300\;\rm ^\circ\rm C$时,向容积为$2\text{ L}$的恒容密闭容器中,充入$2\text{ mol C}{{\text{O}}_{2}}(\text{g})$和$2\;\rm \text{mol }{{\text{H}}_{2}}(\text{g})$,反应过程中测得各物质的物质的量浓度随时间变化如图所示。回答下列问题:
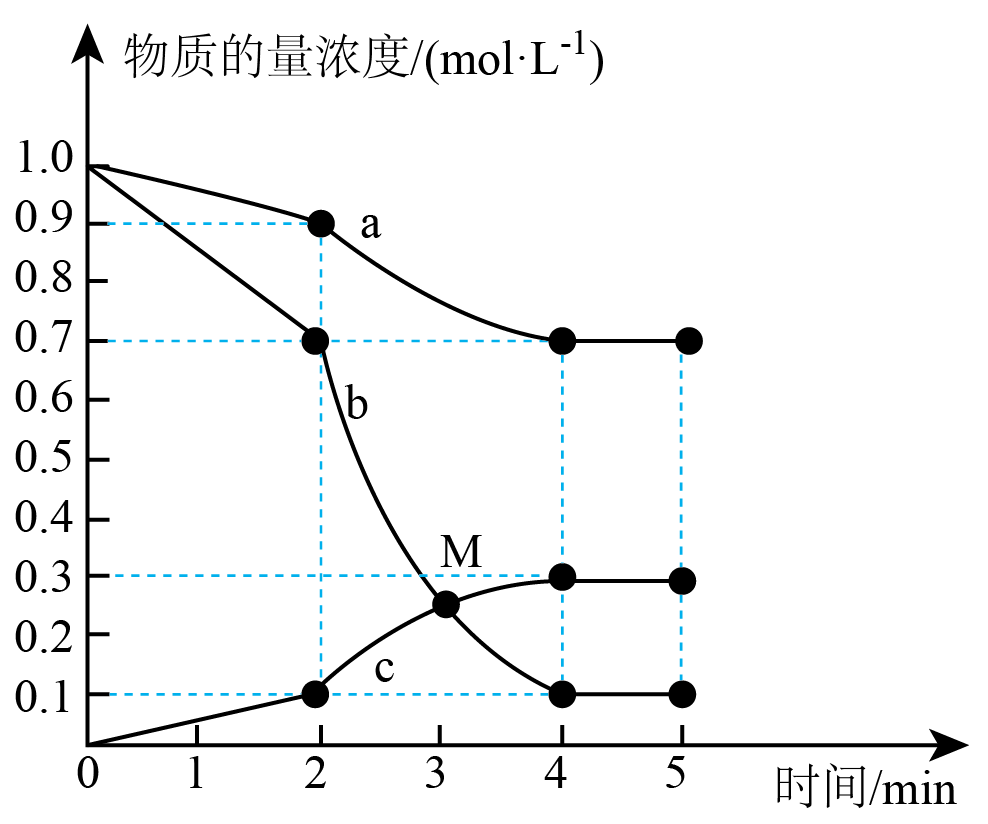
①$\rm \mathrm{H}_{2}(\mathrm{g})$的浓度随时间变化曲线为 $\rm ($填“$\rm a$”、“$\rm b$”或“$\rm c$”$\rm )$;在$\rm M$点,${{ {v}}_{\text{(正)}}}$ $v_{(逆)} ($填“$\rm \gt $”、“$\rm =$”或“$\rm \lt $”$\rm )$。
②$2\;\rm \text{min}$时,反应速率改变的原因可能是 。
$\rm A$.升高温度 $\rm B$.降低温度 $\rm C$.充入一定量的$\rm {{\text{H}}_{2}}$ $\rm D$.加入催化剂
③下列叙述不能说明该反应达到平衡状态的是 。
$\rm A$.$ {c}\left( \text{C}{{\text{H}}_{3}}\text{OH} \right)= {c}\left( {{\text{H}}_{2}}\text{O} \right)$
$\rm B$.混合气体的密度不再变化
$\rm C$.混合气体的平均摩尔质量不再变化
$\rm D$.单位时间内生成$0.1\text{ mol C}{{\text{O}}_{2}}$,同时消耗$0.3\;\rm \text{mol}{{\text{ H}}_{2}}$
$\\rm b$;$\\rm \\gt $;$\\rm AD$;$\\rm AB$
"]]①根据反应的化学方程式为$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})$可知$\rm H_{2}$的反应速率为$\rm CO_{2}$的速率的$\rm 3$倍,故曲线$\rm b$为$\rm \mathrm{H}_{2}(\mathrm{g})$的浓度随时间变化;在$\rm M$点,反应物的浓度在减小,生成物的浓度在增加,反应正向进行,故${{ {v}}_{\text{(正) }}} \gt {{ {v}}_{(逆)}}$。
②$2\;\rm \text{min}$时,反应速率加快,但物质的浓度不变,故为升高温度或加入催化剂,故选:$\rm AD$。
③$\rm A$.反应的任意时刻$ {c}\left( \text{C}{{\text{H}}_{3}}\text{OH} \right)= {c}\left( {{\text{H}}_{2}}\text{O} \right)$,不能说明反应达到了平衡,故$\rm A$符合题意;
$\rm B$.混合气体的容器体积不变,质量不变,故密度为不变的值,混合气体的密度不再变化时反应不一定达到了平衡,故$\rm B$符合题意;
$\rm C$.混合气体质量不变,但是气体的物质的量变化,故气体的平均摩尔质量为变量,混合气体的平均摩尔质量不再变化时反应达到了平衡,故$\rm C$不符合题意;
$\rm D$.单位时间内生成$0.1\text{ mol C}{{\text{O}}_{2}}$,同时消耗$0.3\;\rm \text{mol}{{\text{ H}}_{2}}$,说明反应的正逆反应速率相等,反应达到了平衡,故$\rm D$不符合题意。
高中 | 化学平衡图像分析题目答案及解析(完整版)
