高中 | 转化率、产率 题目答案及解析
稿件来源:高途
高中 | 转化率、产率题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
转化率、产率
某温度时,在$\rm 2\;\rm L$恒容密闭容器中$\rm X$、$\rm Y$、$\rm Z$三种气体的物质的量随时间的变化关系如图所示。
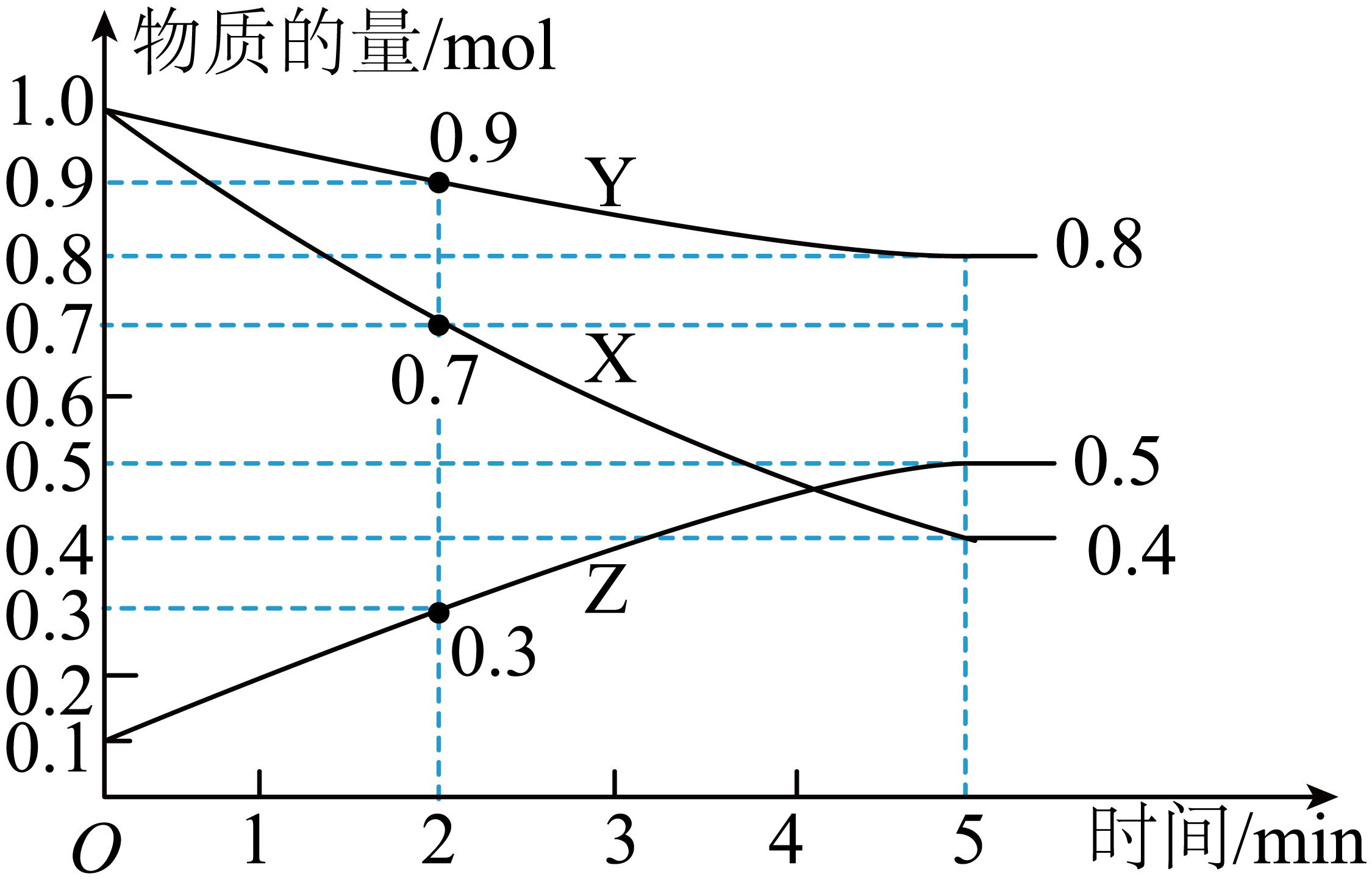
由图中的数据分析可知,该反应的化学方程式为 。
$\\rm 3X(g)+Y(g)\\rightleftharpoons \\rm 2Z(g)$
"]]随着反应的进行,$\rm X$、$\rm Y$物质的量减小直至$\rm 5\;\rm min$不变,$\rm Z$物质的量增大直至$\rm 5\;\rm min$不变,则$\rm X$、$\rm Y$为反应物,$\rm Z$为生成物,反应为可逆反应,$\rm 5\;\rm min$后达到平衡,$\rm X$、$\rm Y$、$\rm Z$的化学计量数之比等于物质的量的变化量之比,为:$\rm 0.6:0.2:0.4=3: 1: 2$,则反应的化学方程式为$\rm 3X(g)+Y(g)\rightleftharpoons \rm 2Z(g)$。
$\rm 0\sim 2\;\rm min$内$\rm X$的平均反应速率为 ,平衡时$\rm Y$的转化率为 ,反应前的压强与平衡时的压强之比为 。
$\\rm 0.075\\;\\rm mol\\cdot \\rm L^{-1}\\cdot \\rm min^{-1}$;$\\rm 20\\%$;$\\rm 21: 17$
"]]容器的体积为$\rm 2\;\rm L$,$\rm 0\sim 2\;\rm min$内$\rm X$的平均反应速率为$ v\rm(X)=\dfrac{\dfrac{{(1}{.0-0}{.7)\;mol}}{{2\;\rm L}}}{{2\;\rm min}}\rm ={0}{.075\;\rm mol}\cdot {{{L}}^{{-1}}}\cdot {mi}{{{n}}^{{-1}}}$;平衡时$\rm Y$的转化率为$\dfrac{{(1}{.0-0}{.8)\rm\;mol}}{{1\;\rm mol}}\times 100\%=20\%$,同温同压下,$\dfrac{{{p}_始{}}}{{{p}_平{}}}=\dfrac{{{n}_始{}}}{{{n}_平{}}}=\dfrac{1+1{+0}.1}{{0}.8{+0}.5+0.4}=\dfrac{2.1}{1.7}$,即反应前的压强与平衡时的压强之比$\rm 21: 17$。
该反应是一个放热反应,说明该反应中破坏$\rm 3\;\rm mol\;\rm X$和$\rm 1\;\rm mol\;\rm Y$的化学键吸收的能量 $\rm ($填“$\rm \lt $”“$\rm =$”或“$\rm \gt $”$\rm )$形成$\rm 2\;\rm mol\;\rm Z$的化学键释放的能量。
$\\rm \\lt $
"]]该反应是一个放热反应,说明该反应中破坏$\rm 3\;\rm mol\;\rm X$和$\rm 1\;\rm mol\;\rm Y$的化学键吸收的能量$\rm \lt $形成$\rm 2\;\rm mol\;\rm Z$的化学键释放的能量。
对于该反应,改变其中一个条件,则生成$\rm Z$的速率增大的是$(\quad\ \ \ \ )$。
适当升高温度
","保持温度不变,增大容器体积
","保持容器体积不变,通入氦气
","保持容器体积不变,充入$\\rm X$气体
"]$\rm A\rm .$ 适当升高温度,反应速率增大,则生成$\rm Z$的速率增大,$\rm A$选;
$\rm B\rm .$ 保持温度不变,增大容器体积,气体物质的量浓度减小,反应速率减小,则生成$\rm Z$的速率减小,$\rm B$不选;
$\rm C\rm .$ 保持容器体积不变,通入氦气,气体物质的量浓度不变,反应速率不变,则生成$\rm Z$的速率不变, $\rm C$不选;
$\rm D\rm .$ 保持容器体积不变,充入$\rm X$气体,$\rm X$的浓度增大,反应物浓度增大,则生成$\rm Z$的速率增大,$\rm D$选;
在恒温、恒容的密闭容器中进行上述可逆反应,若平衡后改变温度,容器中气体的平均摩尔质量变大,则反应向 $\rm ($填正或逆$\rm )$反应方向进行。
正
"]]在恒温、恒容的密闭容器中进行上述可逆反应,由于气体总质量不变,若平衡后改变温度,容器中气体的平均摩尔质量变大,则气体的总物质的量减小, 则反应$\rm 3X(g)+Y(g)\rightleftharpoons \rm 2Z(g)$向正反应方向进行。
高中 | 转化率、产率题目答案及解析(完整版)
