高中 | 转化率、产率 题目答案及解析
稿件来源:高途
高中 | 转化率、产率题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
转化率、产率
$\text{C}{{\text{O}}_{2}}$催化加氢制$\text{C}{{\text{H}}_{3}}\text{OH}$能实现碳的循环利用。一定压强下,$\rm 1\text{ mol }\text{C}{{\text{O}}_{2}}$与$\rm 3\text{ mol }{{\text{H}}_{2}}$在密闭容器中发生的反应如下:
Ⅰ.$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})=\text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\qquad\Delta { H}\lt 0$
Ⅱ.$\text{C}{{\text{O}}_{2}}(\text{g})+{{\text{H}}_{2}}(\text{g})=\text{CO}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\qquad\Delta { H}\gt 0$
反应相同时间,测得不同温度下$\text{C}{{\text{O}}_{2}}$转化率和$\text{C}{{\text{H}}_{3}}\text{OH}$选择性如图实验值所示。图中平衡值表示在相同条件下达到平衡状态时$\text{C}{{\text{O}}_{2}}$转化率和$\text{C}{{\text{H}}_{3}}\text{OH}$选择性随温度的变化。已知:$\text{C}{{\text{H}}_{3}}\text{OH}$的选择性$=\dfrac{{{n}_ {生成}}(\text{C}{{\text{H}}_{3}}\text{OH})}{{{n}_ {反应}}(\text{C}{{\text{O}}_{2}})}\times 100\%$。
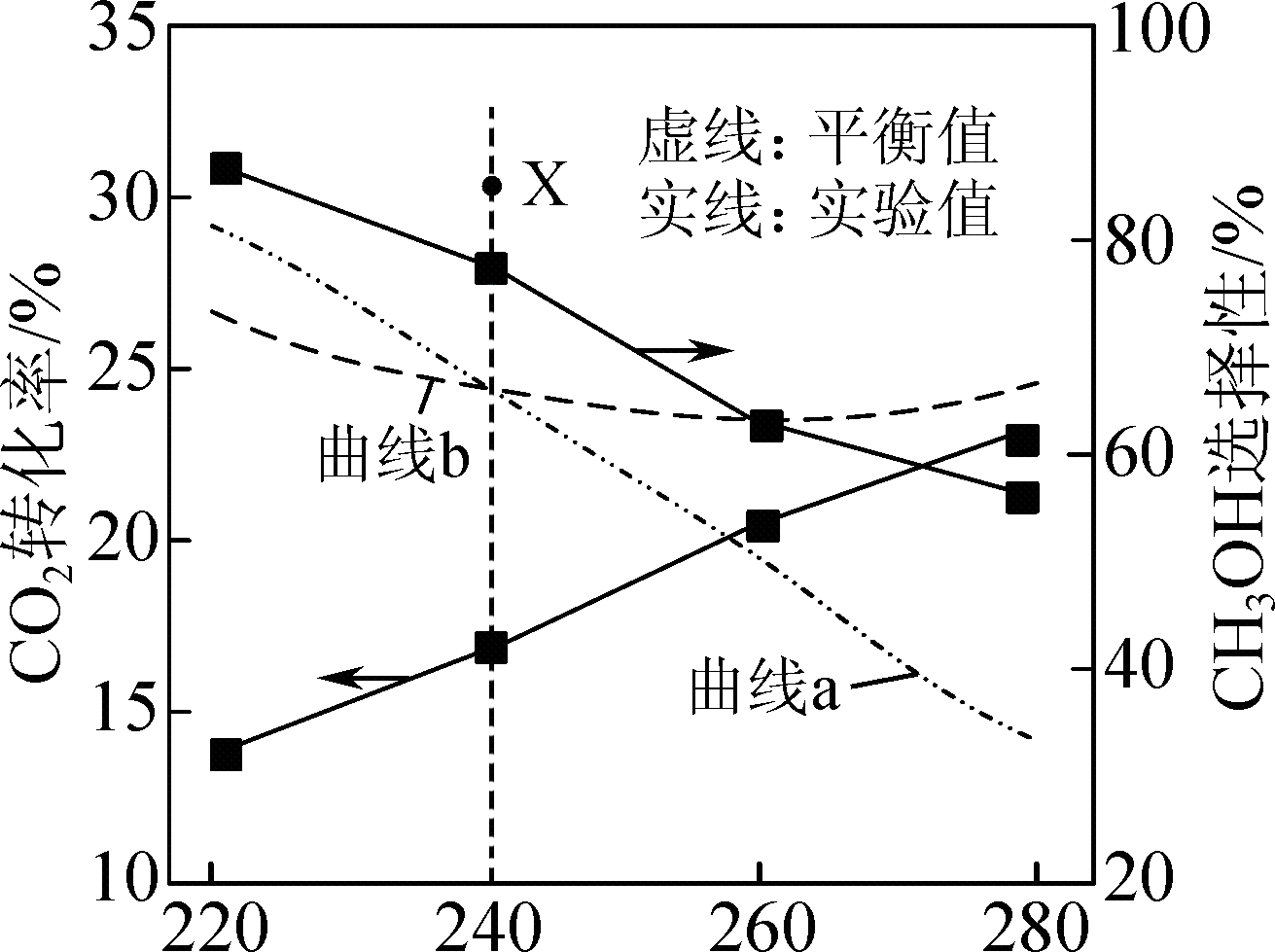
下列说法正确的是$\rm (\qquad)$
曲线$\\rm b$表示$\\rm \\text{C}{{\\text{H}}_{3}}\\text{OH}$选择性
","其他条件不变,$\\rm 240\\;\\rm ^\\circ\\rm C$时使用高效催化剂不能使$\\rm \\text{C}{{\\text{O}}_{2}}$转化率达到$\\rm X$点
","$\\rm 220\\sim 280\\;\\rm ^\\circ\\rm C$时,反应生成$\\rm \\text{C}{{\\text{H}}_{3}}\\text{OH}$速率小于反应生成$\\rm \\text{CO}$的速率
","为提高$\\rm \\text{C}{{\\text{H}}_{3}}\\text{OH}$生产效率,需选择相对较低的温度
"]反应$\rm I$为放热反应,反应$\rm II$为吸热反应,升高温度,反应$\rm I$平衡逆向移动,导致$\rm CO_{2}$的平衡转化率降低,$\rm \text{C}{{\text{H}}_{3}}\text{OH}$选择性降低,反应$\rm II$平衡正向移动导致$\rm CO_{2}$的平衡转化率升高,$\rm CO_{2}$的平衡转化率不会一直随温度的升高而降低,故曲线$\rm b$表示$\rm CO_{2}$的平衡转化率,曲线$\rm a$表示$\rm \text{C}{{\text{H}}_{3}}\text{OH}$选择性,据此分析;
$\rm A$.由分析可知,曲线$\rm a$表示$\rm \text{C}{{\text{H}}_{3}}\text{OH}$选择性,$\rm A$错误;
$\rm B$.使用催化剂对化学平衡无影响,所以使用高效催化剂不可能使$\rm CO_{2}$转化率超过平衡转化率,$\rm B$正确;
$\rm C$.$\rm 260\sim 280$ $\rm ^\circ\rm C$间,$\rm CH_{3}OH$选择性的实验值大于平衡值,说明相同时间内得到的量更多,反应$\rm I$的速率大于反应$\rm II$,即反应Ⅰ生成$\rm CH_{3}OH$速率大于反应Ⅱ生成$\rm CO$的速率,$\rm C$错误;
$\rm D$.温度低反应速率慢,温度升高,$\rm CO_{2}$转化率升高,但$\rm CH_{3}OH$选择性降低,为提高$\rm CH_{3}OH$生产效率,需选择适宜的温度,而不是相对较低的温度,$\rm D$错误。
故选:$\rm B$
高中 | 转化率、产率题目答案及解析(完整版)
