高中 | 转化率、产率 题目答案及解析
稿件来源:高途
高中 | 转化率、产率题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
转化率、产率
Ⅰ. 在$2\;\text{L}$密闭容器内,$800\;\rm^\circ\;C$时反应$2\text{NO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)$体系中,$n\left( \text{NO} \right)$随时间的变化如下表:
| 时间$/\text{s}$ | $\rm 0$ | $\rm 1$ | $\rm 2$ | $\rm 3$ | $\rm 5$ | $\rm 6$ |
| $n\left( \text{NO} \right)/\text{mol}$ | $0.020$ | $0.010$ | $0.008$ | $0.007$ | $0.007$ | $0.007$ |
下图中表示$\text{N}{{\text{O}}_{2}}$的变化的曲线是 $\rm ($填字母$\rm )$。
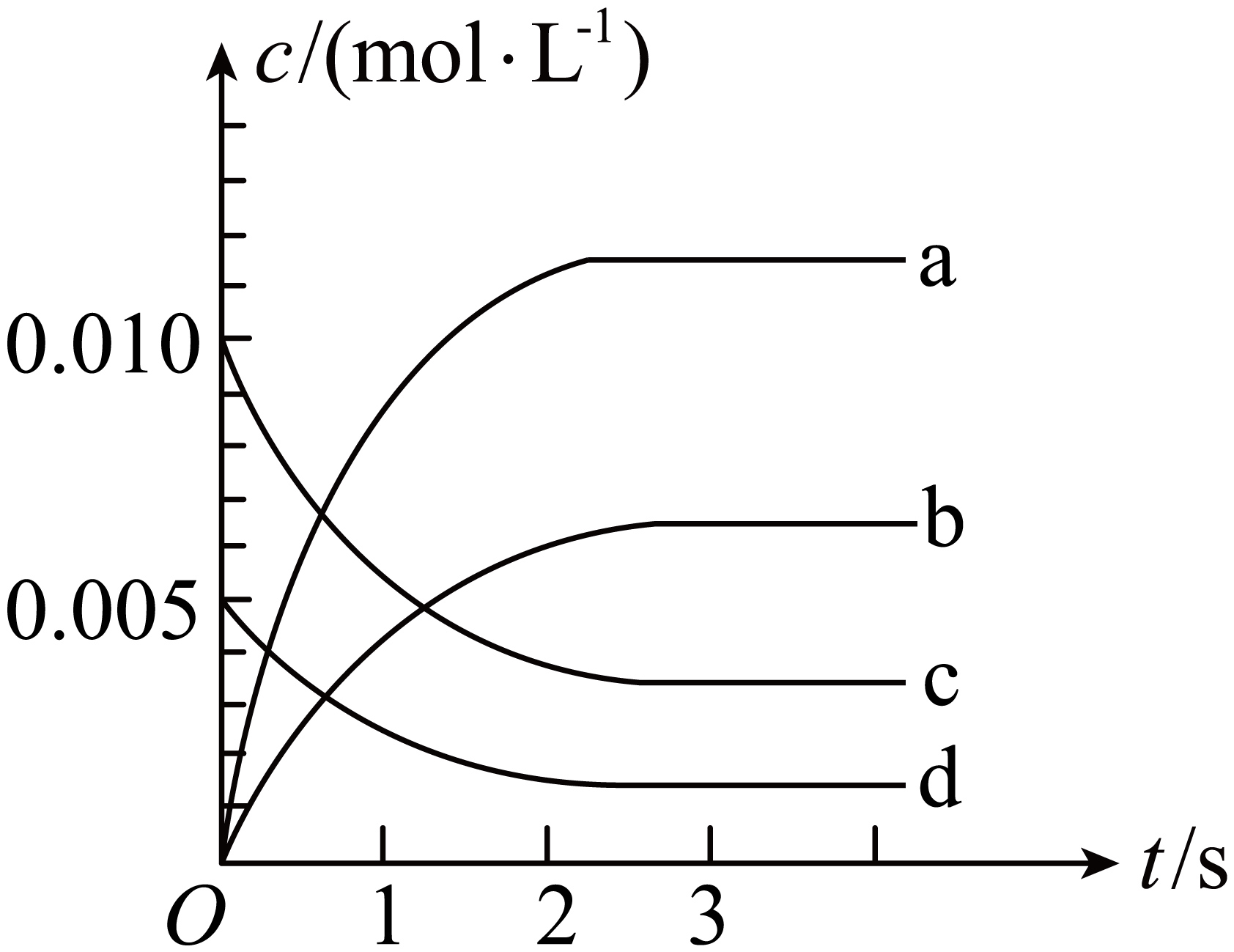
$\\text{b}$
"]]由表中数据可知从$\rm 3\;s$开始,$\rm NO$的物质的量为$\rm 0.007\;\rm mol$,不再变化,$\rm 3\;s$时反应达平衡,$\rm NO_{2}$是产物,随反应进行浓度增大。平衡时$\rm NO$浓度的变化量$\Delta c \rm(NO)=(0.02\;\rm mol-0.007\;\rm mol)/2\;\rm L=0.0065\;\rm mol/L$,所以图中表示$\rm NO_{2}$变化的曲线是$\rm b$;
$\rm 800\;\rm ^\circ\rm C$,反应达到平衡时,$\text{NO}$的转化率是 。
$65\\%$
"]]分析表中数据可知反应在$\rm 3\;s$达到平衡,此时$\rm NO$物质的量为$\rm 0.007\;\rm mol$,$\rm NO$的平衡转化率为$\dfrac{\left( 0.020-0.007 \right)\;\text{mol}}{\text{0.02\;\rm mol}}\times 100\text{ }\!\!\%=65\%$;
用${{\text{O}}_{2}}$表示从$0\sim 2\;\text{s}$内该反应的平均速率$v=$ 。
$0.0015\\;\\rm \\text{mol}/(\\text{L}\\cdot \\text{s})$
"]]$\rm \text{0}\sim2\;s$内$v\text{(NO)=}\dfrac{0.020-0.008}{\text{2}\times \text{2}}\;\text{mol}\cdot {{\text{L}}^{-1}}\cdot {{\text{s}}^{-1}}\text{=3}\text{.0}\times \text{1}{{\text{0}}^{-3}}\;\text{mol}\cdot {{\text{L}}^{-1}}\cdot {{\text{s}}^{-1}}$,根据化学反应速率之比等于化学计量数之比,用${{\text{O}}_{\text{2}}}$表示从$\rm \text{0}\sim 2\;s$内该反应的平均速率为$v\text{(}{{\text{O}}_{2}}\text{)=}\dfrac{1}{2}v\text{(NO)=1}\text{.5}\times \text{1}{{\text{0}}^{-3}}\;\text{mol}\cdot {{\text{L}}^{-1}}\cdot {{\text{s}}^{-1}}$
Ⅱ. 将一定量纯净的氨基甲酸铵$(\text{N}{{\text{H}}_{2}}\text{COONH}{{}_{4}})$置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}\left( \text{s} \right)\rightleftharpoons 2\text{N}{{\text{H}}_{3}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$。
能使该反应的速率增大的是$(\quad\ \ \ \ )$。
及时分离出$\\text{C}{{\\text{O}}_{2}}$气体
","适当升高温度
","加入少量$\\text{N}{{\\text{H}}_{2}}\\text{COONH}_4\\left( \\text{s} \\right)$
","选择高效催化剂
"]$\rm A$.及时分离出$\text{C}{{\text{O}}_{2}}$气体,生成物浓度降低,速率降低,故$\rm A$不选;
$\rm B$.适当升高温度,能加快反应速率,故$\rm B$选;
$\rm C$.再加入少量$\text{N}{{\text{H}}_{2}}\text{COON}{\text{H}_{4}}\left( \text{s} \right)$ ,不影响反应速率,故$\rm C$不选;
$\rm D$.选择高效催化剂,大幅度加快反应速率,故$\rm D$选;
故选:$\rm BD$
下列不能判断该分解反应已经达到化学平衡状态的是 $\rm ($填序号$\rm )$。
①${{v}_{正}}\left( \text{N}{{\text{H}}_{3}} \right)=2{{v}_{逆}}\left( \text{C}{{\text{O}}_{2}} \right)$
②混合气体的密度保持不变
③$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的体积分数保持不变
④密闭容器中气体总压强保持不变
⑤气体的平均相对分子质量保持不变
③⑤
"]]①${{v}_{正}}\left( \text{N}{{\text{H}}_{\text{3}}} \right)\text{=2}{{v}_{逆}}\left( \text{C}{{\text{O}}_{\text{2}}} \right)$表示反应方向相反,且数值之比等于化学计量数之比,则此时反应达平衡状态,故可以作为平衡判断的标志;
②由$\text{N}{{\text{H}}_{\text{2}}}\text{COON}{{\text{H}}_{\text{4}}}\left( \text{s} \right)\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\text{2N}{{\text{H}}_{\text{3}}}\left( \text{g} \right)+\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)$知,恒容密闭容器中气体密度不变,说明所有气体的质量不变,此时正逆反应速率相等,故可以作为平衡判断的标志;
③因为反应物是固体,容器中氨气和二氧化碳的物质的量之比始终为$2:1$,密闭容器中二氧化碳的体积分数始终不变,故不可以作为平衡判断的标志;
④对于反应前后气体体积可变的反应,体系压强不变,则总物质的量不变,则说明反应达到平衡状态,故可以作为平衡判断的标志;
⑤因为反应物是固体,所以整个体系中平均相对分子质量是个定值,故不可以作为平衡判断的标志;
故选:③⑤
Ⅲ. 某甲醛气体探测仪利用燃料电池工作原理对甲醛含量进行检测,电池结构如图所示。
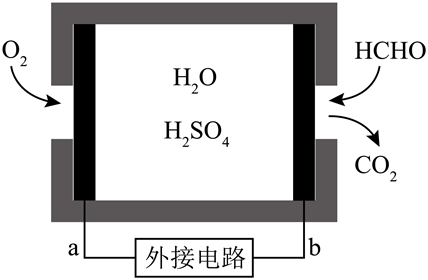
探测仪工作时,电子从 (选填“$\text{a}$”或“$\text{b}$”)极流出,$\text{a}$电极的电极反应式为 。
$\\rm b$ ;${{\\text{O}}_{\\text{2}}}\\text{+4}{{\\text{H}}^{+}}\\text{+4}{{\\text{e}}^{-}}\\text{=2}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]原电池中负极失去电子发生氧化反应,故电子由负极流出,经导线流向正极,故探测仪工作时,电子从$\rm b$极流出,$\rm a$电极为正极,发生还原反应,电极反应式为$\rm {{\text{O}}_{\text{2}}}\text{+4}{{\text{H}}^{+}}\text{+4}{{\text{e}}^{-}}\text{=2}{{\text{H}}_{\text{2}}}\text{O}$
如果在外电路中有$1\;\rm \text{mol}$电子发生转移,则检测出标准状况下甲醛的体积为 $\text{L}$。
$\\rm 5.6$
"]]反应$\rm 1\;\rm mol\;\rm HCHO$失去$\rm 4\;\rm mol$电子,根据电子守恒可知,如果在外电路中有$\rm 1\;\rm mol$电子发生转移,则检测出标准状况下甲醛的体积为$\dfrac{\text{1\;\rm mol}}{\text{4}}\text{ }\!\!\times\!\!\text{ 22}\text{.4 L }\!\!\cdot\!\!\text{ mo}{{\text{l}}^{\text{-1}}}\rm =5.6\;\rm L$
高中 | 转化率、产率题目答案及解析(完整版)
