高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
我国科学家成功用二氧化碳人工合成淀粉,其中第一步是利用二氧化碳催化加氢制甲醇。在$\text{C}{{\text{O}}_{2}}\rm (g)$加氢合成$\text{C}{{\text{H}}_{3}}\text{OH}$的体系中,同时发生以下反应:
反应Ⅰ:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad\Delta{{ {H}}_{1}}\lt 0$
反应Ⅱ:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad\Delta{{ {H}}_{2}}\gt 0$
反应Ⅲ:$\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)\qquad\Delta{{ {H}}_{3}}\lt 0$
反应Ⅰ、Ⅱ、Ⅲ的焓变$\Delta H$随温度$ {T}$的变化如图$\rm 1$所示。表示反应Ⅰ的焓变曲线为 $\rm ($填“$\rm a$”“$\rm b$”或“$\rm c$”$\rm )$,反应Ⅲ在 $\rm ($填“高温”“低温”或“任何温度”$\rm )$下可自发进行。
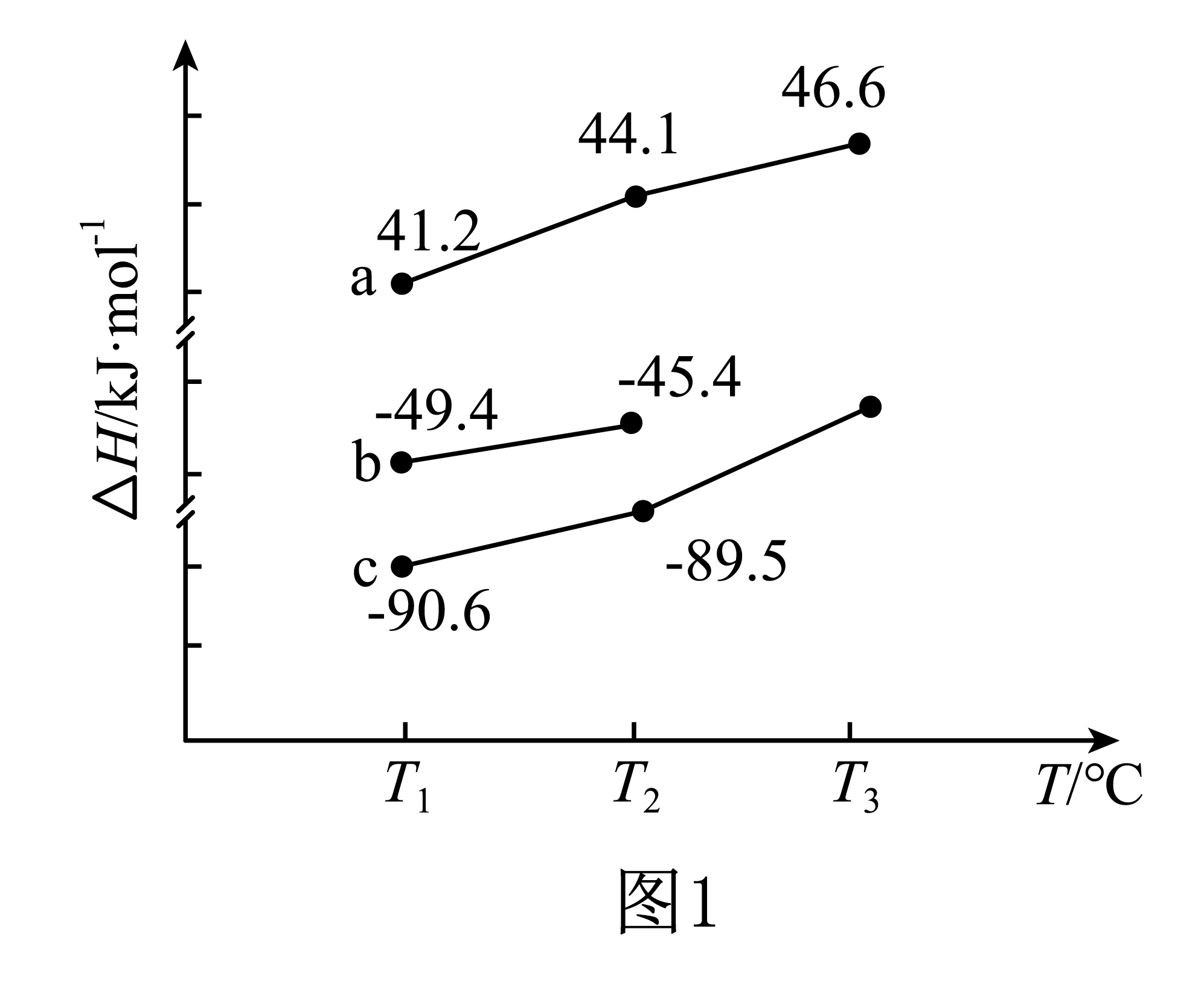
$\\rm b$;低温
"]]依据盖斯定律Ⅰ$\rm -$Ⅱ可得Ⅲ,只有反应$\rm II$的$\Delta H_{2}\gt 0$,则曲线$\rm a$代表$\rm II$,将$ T_{1}$时各曲线数据代入$\rm -49.4-41.2=-90.6$,则曲线$\rm b$代表$\rm I$,曲线$\rm c$代表$\rm III$;反应$\rm III$是气体分子数减小的反应,则$\Delta S\lt 0$,已知$\Delta H_{3}\lt 0$,故低温时,$\Delta H-T\Delta S\lt 0$反应自发;
在恒容密闭容器中按$ {n}\left( \text{C}{{\text{O}}_{2}} \right):{n}\left( {{\text{H}}_{2}} \right)\rm =1: 3$投料进行上述反应,$\text{C}{{\text{O}}_{2}}$的平衡转化率和甲醇的选择性随温度的变化趋势如图$\rm 2$所示:
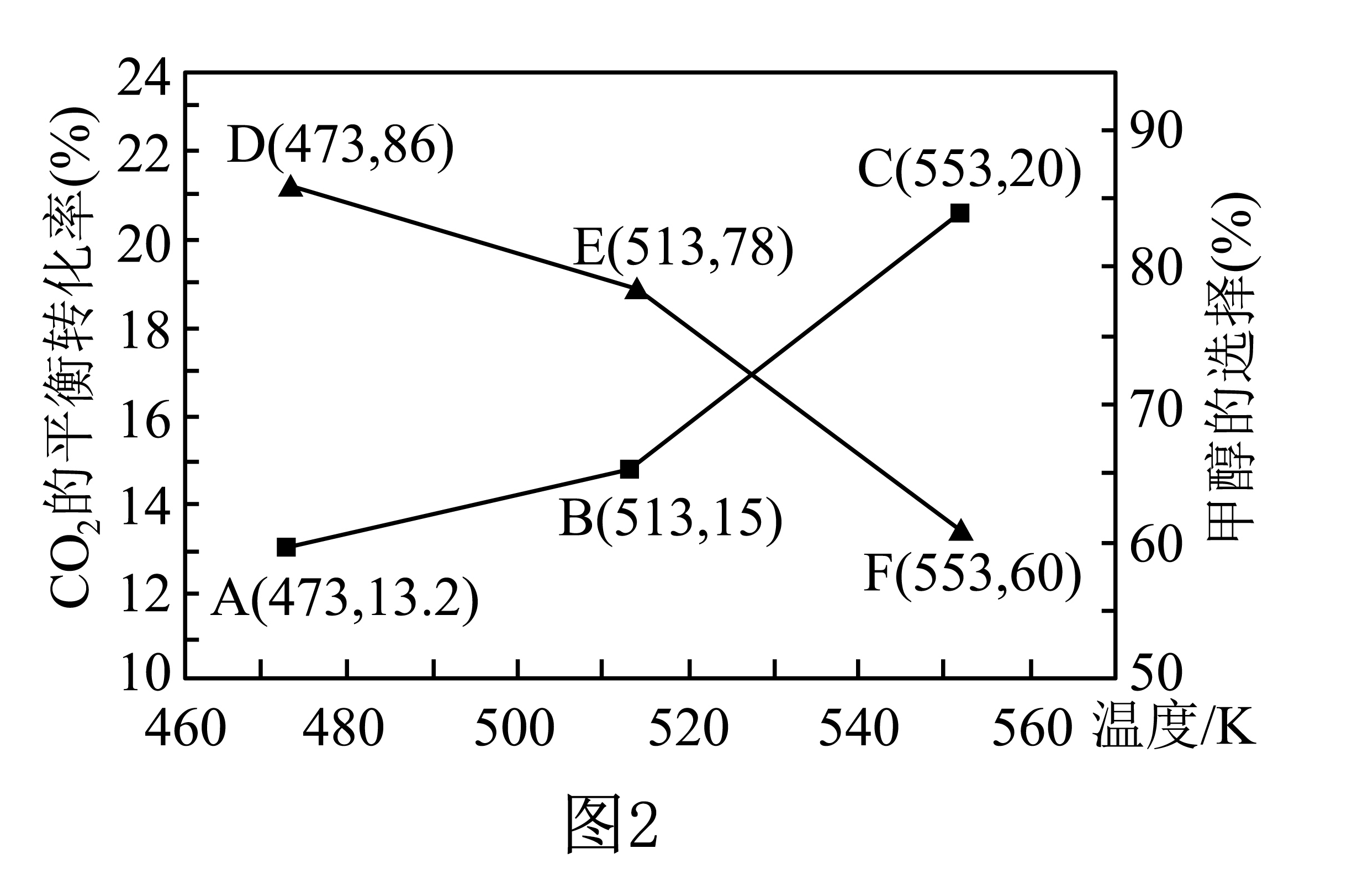
$\text{C}{{\text{H}}_{3}}\text{OH}$的选择性$ =\dfrac{ {n}\left( 生成\text{C}{{\text{H}}_{3}}\text{OH}消耗的\text{C}{{\text{O}}_{2}} \right)}{ {n}\left( 消耗\text{C}{{\text{O}}_{2}}的总量 \right)}\times 100\%$,温度对催化剂的影响可以忽略。
①根据图中数据,温度选择 $\rm K($填标号$\rm )$,达到平衡时反应体系内甲醇的产量最高。
$\rm a$.$\rm 473$ $\rm b$.$\rm 513$ $\rm c$.$\rm 553$
②在图示温度范围内,随着温度的升高,$\text{C}{{\text{O}}_{2}}$的平衡转化率 $\rm ($填“升高”“降低”或“不变”,下同$\rm )$,甲醇的选择性 ,甲醇的选择性变化的原因是 。
$\\rm c$;升高;降低;当温度升高时反应$\\rm I$和Ⅲ平衡逆向移动,而反应Ⅱ平衡正向移动
"]]①令$n\rm (CO_{2})=1\;\rm mol$,$n\rm (H_{2})=3\;\rm mol$,温度为$\rm 473\;K$时,生成甲醇的物质的量为$\rm 1\times 13.2\%\times 86\%\;mol=0.11352\;\rm mol$;温度为$\rm 513\;K$时,生成甲醇的物质的量为$\rm 1\times 15\%\times 78\%\;mol=0.117\;\rm mol$;温度为$\rm 553\;K$时,生成甲醇的物质的量为$\rm 1\times 21\%\times 60\%\;mol=0.126\;\rm mol$;因此温度为$\rm 553\;K$时,达到平衡,反应体系内甲醇的产量最高;
②随着温度的升高,$\rm CO_{2}$的平衡转化率增加但甲醇的选择率降低,原因为当温度升高时反应Ⅰ和$\rm III$平衡逆向移动,而反应Ⅱ平衡正向移动且幅度更大,所以$\rm CO_{2}$的转化率增加,但甲醇的选择性却降低;
温度${{ {T}}_{2}}$时,在容积不变的密闭容器中,充入$0.5\text{ mol C}{{\text{O}}_{2}}\rm (g)$和$1.0\;\rm \text{mol}{{\text{ H}}_{2}}\rm (g)$,起始压强为$ {p\;\rm kPa}$,$\rm 10\;\rm min$达平衡时生成$0.3\;\rm \text{mol}{{\text{ H}}_{2}}\text{O}\rm (g)$,测得压强为$\dfrac{\text{2}}{\text{3}} p\;\rm kPa$。则反应过程中的热效应为 $\rm kJ$,若反应速率用单位时间内分压变化表示,则$\rm 10\;\rm min$内生成$\text{C}{{\text{H}}_{3}}\text{OH}$的反应速率$ {v}\left( \text{C}{{\text{H}}_{3}}\text{OH} \right)$为 $ \text{kPa}\cdot \text{mi}{{\text{n}}^{-1}}$,反应Ⅱ的压强平衡常数${{ {K}}_{\text{p}}}\rm =$ 。$\rm ($已知:分压$\rm =$总压$\rm \times $该组分物质的量分数$\rm )$
$\\rm -9.145$;$ 0.0167p($或$\\dfrac{ {p}}{60}\\rm )$;$\\rm 0.375$或$\\dfrac{3}{8}$
"]]起始气体总物质的量为$\rm 1.5\;\rm mol$,压强$ p\;\rm kPa$,平衡状态压强$\dfrac{2}{3} p\;\rm kPa$,则平衡气体总物质的量为$\rm 1\;\rm mol$,$\rm 10\;\rm min$达平衡时生成$\rm 0.3\;\rm mol\;\rm H_{2}O(g)$,列三段式:
反应$\rm I$ $\begin{matrix} {} & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & + & \text{3}{{\text{H}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) \\ 起始量\text{/mol} & 0.5 & {} & \text{1}\text{.0} & {} & \text{0} & {} & \text{0} \\转化量 \text{/mol} & {x} & {} & {3x} & {} & {x} & {} & {x} \\ 平衡量\text{/mol} & {} & {} & {} & {} & {} & {} & {} \\ \end{matrix}$
反应$\rm II\begin{matrix} {} & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & \text{CO}\left( \text{g} \right) & + & {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) \\ 起始量\text{/mol} & 0.5 & {} & \text{1}\text{.0} & {} & \text{0} & {} & \text{0} \\ 转化量\text{/mol} & {y} & {} & {y} & {} & {y} & {} & {y} \\平衡量 \text{/mol} & {} & {} & {} & {} & {} & {} & {} \\ \end{matrix}$
$x+y=0.3$、$(0.5-x-y)+(1-3x-y)+(x+y)+(x+y) =1$,解得$x=0.25$,$y=0.05$,则$T_{2}$时反应过程中的热效应为$\rm 0.25\;\rm mol\times 45.4\;\rm kJ/mol-0.05\;\rm mol\times 44.1\;\rm kJ/mol=9.145\;\rm kJ$;
生成甲醇物质的量$\rm 0.25\;\rm mol$,甲醇分压${ p\rm(CH_{3}OH)}=\dfrac{\text{0} {.25\;\rm mol}}{\text{1} {.5\;\rm mol}}\times {p\rm\;kPa}=\dfrac{{p}}{6}\text{ kPa}$,则$\rm 10\;\rm min$内生成$\rm CH_{3}OH$的反应速率$ {v\rm(CH_{3}OH)}=\dfrac{\dfrac{{p}}{6}\text{ kPa}}{10\;\rm \text{min}}=\dfrac{{p}}{60}\text{ kPa}\cdot \text{mi}{{\text{n}}^{\text{-1}}}$;
反应Ⅱ中各物质的分压为:${ p\rm(CO_{2})}=\dfrac{\text{0}\text{.2}}{\text{1}\text{.5}}\times {p\rm\;kPa}$,${p\rm(H_{2})}=\dfrac{\text{0}\text{.2}}{\text{1}\text{.5}}\times {p\rm\;kPa}$,${p\rm(H_{2}O)}=\dfrac{\text{0}\text{.3}}{\text{1}\text{.5}}\times {p\rm\;kPa}$,${p\rm(CH_{3}OH)}=\dfrac{\text{0}\text{.05}}{\text{1}\text{.5}}\times {p\rm\;kPa}$,反应Ⅱ的平衡常数${{ {K}}_{\text{p}}}=\dfrac{\left( \dfrac{0.05}{1.5}{p} \right)\times \left( \dfrac{0.3}{1.5}{p} \right)}{\left( \dfrac{0.2}{1.5}{p} \right)\times \left( \dfrac{0.2}{1.5}{p} \right)}=0.375$。
高中 | 化学平衡常数题目答案及解析(完整版)
