高中 | 铁的氧化物 题目答案及解析
稿件来源:高途
高中 | 铁的氧化物题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁的氧化物
铁及其化合物在日常生活中有广泛应用。
向硫酸亚铁溶液中滴加氢氧化钠溶液,生成白色沉淀,迅速 $\rm ($补全实验现象$\rm )$,化学方程式为 、 。
变灰绿色,最终变为红褐色;$\\rm FeS{{O}_{4}}+2NaOH=Fe{{(OH)}_{2}}\\downarrow +N{{a}_{2}}S{{O}_{4}}$;$\\rm 4Fe{{(OH)}_{2}}+{{O}_{2}}+2{{H}_{2}}O=4Fe{{(OH)}_{3}}$
"]]向硫酸亚铁溶液中滴加氢氧化钠溶液,生成白色沉淀,迅速变灰绿色,最终变为红褐色,发生的化学方程式为:$\rm FeS{{O}_{4}}+2NaOH=Fe{{(OH)}_{2}}\downarrow +N{{a}_{2}}S{{O}_{4}}$、$\rm 4Fe{{(OH)}_{2}}+{{O}_{2}}+2{{H}_{2}}O=4Fe{{(OH)}_{3}}$。
绿矾$\rm (FeS{{O}_{4}}\cdot 7{{H}_{2}}O)$是补血剂的原料,易变质。设计实验证明绿矾未完全变质 。
取样品溶于水,滴加酸性高锰酸钾溶液,溶液褪色,则表示样品未完全变质
"]]检验绿矾未完全被氧化变质,即检验其溶液中还含有$\rm Fe^{2+}$,则证明绿矾未完全变质的实验方案为:取样品溶于水,滴加酸性高锰酸钾溶液,溶液褪色,则表示样品未完全变质。
利用绿矾制备还原铁粉的工业流程如下。
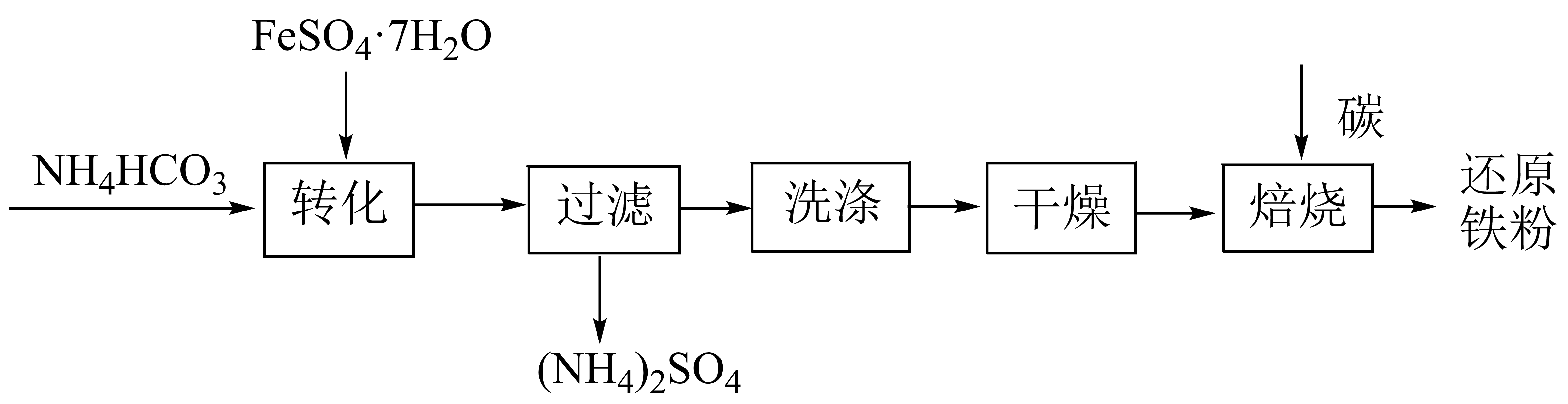
①“转化”是在水溶液中进行,产生白色沉淀$\rm (FeC{{O}_{3}})$和无色无味气体。写出反应的离子方程式: 。
②干燥过程主要是为了脱去游离水和结晶水,过程中会有少量$\rm FeC{{O}_{3}}$在空气中被氧化为$\rm FeOOH$,该反应的化学方程式为 。
$\\rm F{{e}^{2+}}+2HCO_{3}^{-}=FeC{{O}_{3}}\\downarrow +{{H}_{2}}O+C{{O}_{2}}\\uparrow $;$\\rm 4FeC{{O}_{3}}+{{O}_{2}}+2{{H}_{2}}O=4FeOOH+4C{{O}_{2}}$
"]]“转化”中发生离子反应:$\rm F{{e}^{2+}}+2HCO_{3}^{-}=FeC{{O}_{3}}\downarrow +{{H}_{2}}O+C{{O}_{2}}\uparrow $,过滤分离出硫酸铵,然后将$\rm FeCO_{3}$洗涤,干燥过程主要是为了脱去游离水和结晶水,过程中会有少量$\rm FeCO_{3}$在空气中被氧化为$\rm FeOOH$,该反应的化学方程式为:$\rm 4FeC{{O}_{3}}+{{O}_{2}}+2{{H}_{2}}O=4FeOOH+4C{{O}_{2}}$,$\rm FeCO_{3}$与碳混合后焙烧,最终得到还原铁粉。
①“转化”是在水溶液中进行,产生白色沉淀$\rm (FeC{{O}_{3}})$和无色无味气体,该气体为$\rm CO_{2}$,反应的离子方程式为:$\rm F{{e}^{2+}}+2HCO_{3}^{-}=FeC{{O}_{3}}\downarrow +{{H}_{2}}O+C{{O}_{2}}\uparrow $。
②少量$\rm FeCO_{3}$在空气中被氧气氧化为$\rm FeOOH$,同时生成$\rm CO_{2}$,该反应的化学方程式为:$\rm 4FeC{{O}_{3}}+{{O}_{2}}+2{{H}_{2}}O=4FeOOH+4C{{O}_{2}}$。
某同学在实验室进行铁盐与亚铁盐相互转化的实验。
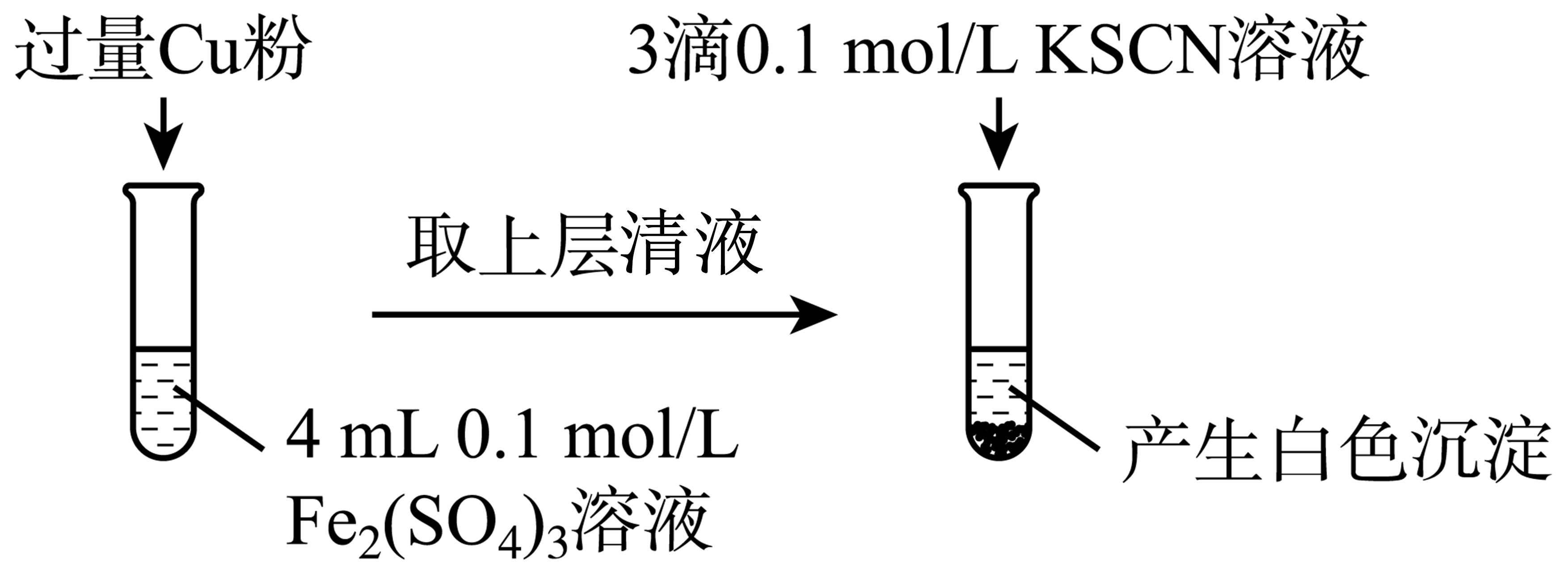
实验$\rm I$:将$\rm F{{e}^{3+}}$转化为$\rm F{{e}^{2+}}$。
①$\rm F{{e}^{3+}}$与$\rm Cu$粉发生反应的离子方程式为 。
②探究白色沉淀产生的原因,请填写实验方案:查阅资料。
$\rm i$.$\rm {{(SCN)}_{2}}$的化学性质与$\rm {{I}_{2}}$相似。
$\rm ii$.$\rm 2C{{u}^{2+}}+4{{I}^{-}}=2CuI\downarrow +{{I}_{2}}$。
$\rm C{{u}^{2+}}$与$\rm SCN{{}^{\cdot }}$反应的离子方程式为 。
实验Ⅱ:将$\rm F{{e}^{2+}}$转化为$\rm F{{e}^{3+}}$
| 实验方案 | 现象 |
| 向$\rm 0.1\ mol/L\ FeC{{l}_{2}}$溶液中加入一滴$\rm KSCN$溶液;再通入氯气。 | 溶液颜色无明显变化;溶液变红,一段时间后红色消失。 |
③用离子方程式表示溶液变红的原因是 、$\rm F{{e}^{3+}}+3SC{{N}^{-}}\rightleftharpoons Fe{{(SCN)}_{3}}$。
④探究红色消失的原因,继续查阅资料:$\rm iii$.$\rm {SCN}^{-}$中$\rm C$为$\rm +4$价,$\rm N$为$\rm -3$价,可被强氧化剂氧化为$\rm C{{O}_{2}}$、$\rm {{N}_{2}}$和$\rm SO_{4}^{2-}$。用离子方程式表示红色消失的原因为: 。
$\\rm 2F{{e}^{3+}}+Cu=2F{{e}^{2+}}+C{{u}^{2+}}$;$\\rm 2C{{u}^{2+}}+4SC{{N}^{-}}=2CuSCN\\downarrow +{{(SCN)}_{2}}$;$\\rm 2F{{e}^{2+}}+C{{l}_{2}}=2F{{e}^{3+}}+2C{{l}^{-}}$;$\\rm 12{{H}_{2}}O+2SC{{N}^{-}}+11C{{l}_{2}}=22C{{l}^{-}}+{{N}_{2}}+2C{{O}_{2}}+2SO_{4}^{2-}+24{{H}^{+}}$
"]]①$\rm Fe^{3+}$与$\rm Cu$粉发生反应生成$\rm Fe^{2+}$和$\rm Cu^{2+}$,反应的离子方程式为:$\rm 2F{{e}^{3+}}+Cu=2F{{e}^{2+}}+C{{u}^{2+}}$。
②已知:$\rm i$.$\rm {{(SCN)}_{2}}$的化学性质与$\rm {{I}_{2}}$相似;$\rm ii$.$\rm 2C{{u}^{2+}}+4{{I}^{-}}=2CuI\downarrow +{{I}_{2}}$。采用类比法,可得出$\rm Cu^{2+}$与$\rm {SCN}^{-}$反应的离子方程式为:$\rm 2C{{u}^{2+}}+4SC{{N}^{-}}=2CuSCN\downarrow +{{(SCN)}_{2}}$。
③氯气将氯化亚铁氧化为氯化铁,氯化铁再与$\rm KSCN$反应导致溶液变红,则用离子方程式表示溶液变红的原因是:$\rm 2F{{e}^{2+}}+C{{l}_{2}}=2F{{e}^{3+}}+2C{{l}^{-}}$、$\rm F{{e}^{3+}}+3SC{{N}^{-}}\rightleftharpoons Fe{{(SCN)}_{3}}$。
④$\rm {SCN}^{-}$中$\rm C$为$\rm +4$价,$\rm N$为$\rm -3$价,可被强氧化剂氧化为$\rm C{{O}_{2}}$、$\rm {{N}_{2}}$和$\rm SO_{4}^{2-}$,即$\rm {SCN}^{-}$被氯气氧化生成$\rm C{{O}_{2}}$、$\rm {{N}_{2}}$和$\rm SO_{4}^{2-}$,氯气被还原为氯离子,则用离子方程式表示红色消失的原因为:$\rm 12{{H}_{2}}O+2SC{{N}^{-}}+11C{{l}_{2}}=22C{{l}^{-}}+{{N}_{2}}+2C{{O}_{2}}+2SO_{4}^{2-}+24{{H}^{+}}$。
高中 | 铁的氧化物题目答案及解析(完整版)
